Z-DNA

Z-DNAまたはZ型DNAは、DNAがとりうる二重らせん構造のうちの1つである。一般的な右巻きのB-DNAとは異なり、左方向へジグザグに巻いた二重らせん構造をしている。Z-DNAは、A-DNA、B-DNAとともに生物学的活性のある3つの二重らせん構造の1つであると考えられている。
歴史
[編集]左巻きDNAは、Robert Wellsらによるイノシン-シトシン多量体の研究を通じて発見された[1]。彼らはこのDNAのCDスペクトルが「逆向き」であることを観察し、DNAの二本鎖が左巻きのらせんを形成していると解釈した。Z-DNAと一般的なB-DNAとの関係性は、PohlとJovinによって示唆された[2]。彼らはグアニン-シトシン多量体のCDスペクトルが 4 M塩化ナトリウム溶液中でほぼ反転することを示した。このスペクトルの反転がB-DNAからZ-DNAへの変換によるものであることは、溶液と結晶のラマンスペクトルによって確証された[3]。1979年にマサチューセッツ工科大学(MIT)のAndrew Wang、アレクサンダー・リッチらによってZ-DNAの結晶構造が解かれ、ワトソン-クリック型塩基対によって保持された、2本の逆平行鎖からなる左巻き二重らせん構造が明らかにされた。これは、DNA断片(自己相補的な6-mer DNA d(CG)3)の最初の単結晶構造であった[4]。B-DNAからZ-DNAに変化する接合部(B-Zジャンクション)の結晶化が2005年に行われ[5]、細胞内におけるZ-DNAの役割に関してより良い理解がもたらされた。Z-DNAからなる断片が形成される際には、ゲノムの残りの部分を構成するB-DNAとの接続を行うB-Zジャンクションがその両端に存在しなければならない。
RNAに関しても、A型の二重らせん(A-RNA)が左巻きのZ-RNAへ変換されることが1984年に報告された[6]。2007年にはZ-RNAの結晶構造が解かれた[7]。
構造
[編集]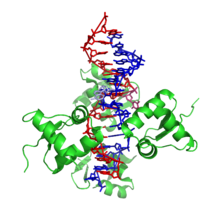
Z-DNAは右巻きの二重らせんとは大きく異なる。Z-DNAのらせんは左巻きであり、2塩基対を単位とするリピート構造を持っている。A-DNAやB-DNAとは異なり、主溝(major groove)と副溝(minor groove)の幅にはほとんど差がない。一般的にこの構造の形成はエネルギー的に不利であるが、プリンとピリミジンが交互に並んだ配列(特にGCが並んだ配列)、負のDNA超らせん、一部のカチオンを含む高塩濃度環境など、特定の状況下では促進される(これらはすべて37°C、pH 7.3–7.4の生理的条件下で起こる)。Z-DNAとB-DNAの接合部(B-Zジャンション)では、塩基対の突出を伴う構造が形成される[8]。Z-DNAのコンフォメーションの研究は安定な二重らせんとして存在しないため困難なものとなっている。Z-DNAは生物学的活動によって時折誘導され、その後迅速に消失する一過的構造である[9]。
Z-DNA構造の予測
[編集]DNA配列からZ-DNA構造の形成可能性を予測することは可能である。B型からZ型へ変換される傾向の予測を行うアルゴリズムZHuntはMITのP. Shing Hoによって書かれた[10]。その後、Z-DNAのゲノムワイドマッピングへ向けたアルゴリズムの開発が行われた[11]。
Z-DNAの形成経路
[編集]1979年のZ-DNAの発見と結晶化以降、科学者たちはB-DNAからZ-DNAが形成される経路と機構について頭を悩ませてきた[12]。B-DNAからZ-DNA構造へ変換過程の原子レベルでのコンフォメーション変化は不明であったが、2010年にLeeらによる計算機シミュレーションによって、以前想定されていたような全領域が協奏的にZ-DNAへ変換される経路よりも、Z-DNA構造が2塩基ごとに段階的に伝播していく経路のほうがB型からZ型への転換のエネルギー障壁が低いことが明らかにされた[13]。2018年、この転換経路は1分子FRET(smFRET)解析によって実験的にも証明された[14]。実験的検証では、B-DNAからZ-DNAの転換を誘導するため、Z-DNAに対して高い親和性で結合するヒトタンパク質ADAR1のZαドメイン(hZαADAR1)[15]がさまざまな濃度で用いられた[14]。smFRETアッセイでは、hZαADAR1の結合によってB*遷移状態と呼ばれる中間的状態がB-DNA構造上に蓄積し、安定化されることが明らかにされた[14]。この段階を経ることでジャンクションの高エネルギー状態を避けることが可能となり、B-DNAは大きな破壊的なエネルギー変化なしにZ-DNA構造へとコンフォメーション変化を行えるようになっている。この結果は、Leeらの計算機による結果と一致しており、B-DNAからZ-DNAへの転換は段階的に進行する機構であることと、それによってコンフォメーション変化のエネルギー障壁が低くなることが実証された[13]。以前考えられていたのとは異なり、結合タンパク質は実際にはZ-DNA構造が形成された後の安定化は行っておらず、B*型コンフォメーションからZ-DNAへの形成の促進を行っている[14]。
生物学的意義
[編集]Z-DNAがI型インターフェロン応答の調節に関係していることは、遺伝性対側性色素異常症(OMIM: 127400)、エカルディ・グティエール症候群(615010)、両側線条体壊死/ジストニアという、3つの希少遺伝疾患の研究によって確認された。これらの疾患はADARの変異によって引き起こされる。ADARのZαドメインの発現が1つのコピーからしか起こらない家族のトランスクリプトーム解析によって、DNAの遺伝的情報は配列だけでなく形状によってもコードされていることが示された[16]。がんにおいてもZ-DNAがインターフェロン応答を調節していることは、多くの腫瘍で約40%が生存をADARに依存していることからも支持される[17]。
Z-DNAはアルツハイマー病と全身性エリテマトーデス(SLE)の双方とも関連付けられている。脳の海馬の正常領域、アルツハイマー病の影響を中等度に受けた領域、重度に受けた領域のDNAについて、CDスペクトルを用いた研究が行われ、重度の影響を受けた領域にはZ-DNAが存在することが示された[18]。また、中等度の影響を受けた領域のDNAの大部分はB-Z中間型のコンフォメーションであった。これらからは、アルツハイマー病の進行に依存してB-DNAからZ-DNAへの転換が起こることが示唆される[18]。SLEに関しては、Z-DNAに対する自然抗体がこの疾患と関係している。SLEの患者では多量の抗Z-DNA抗体がみられるが、他のリウマチ性疾患ではみられない[19]。抗体には2つのタイプが存在し、一方はZ-DNA表面に露出した塩基と相互作用し、もう一方はZ-DNAのみに存在するジグザグ状の主鎖と相互作用する。アルツハイマー病のケースと同様に、抗体は疾患のステージによって変動し、最も活動的な段階で最大量の抗体がみられる。
転写における役割
[編集]Z-DNAは一般的に転写中のねじれひずみ(torsional strain)の解消をもたらすと考えられており、負の超らせんの形成と関係している[5][20]。超らせんはDNAの転写と複製の双方と関係しているが、Z-DNAの形成は主に転写率と関係している[21]。
ヒトの22番染色体の研究からは、Z-DNA形成領域とNFI転写因子が結合するプロモーター領域には相関があることが示された。このことは、ヒトの一部の遺伝子の転写はZ-DNAの形成とNFIの活性化によって調節されている可能性を示唆している[11]。
プロモーター領域の下流に存在するZ-DNA配列は、転写を促進することが示されている。転写活性の増加が最大となるのは、Z-DNA配列がプロモーター配列から3ターン分だけ下流に位置しているときである。さらに、Z-DNAはヌクレオソームを形成しにくいため、多くの場合ヌクレオソームはZ-DNA形成配列の後から配置される。この性質のため、Z-DNAはヌクレオソームの配置をコードしているという仮説が立てられている。ヌクレオソームの配置は転写因子の結合に影響を与えるため、Z-DNAは転写率を調節すると考えられている[22]。
Z-DNAはRNAポリメラーゼの後方で一過的に形成されるため、活発な転写によって形成されたZ-DNAは遺伝的不安定性を増大させ、プロモーター近傍での変異傾向を生み出す[23]。大腸菌Escherichia coliの研究では、プラスミド中のZ-DNA形成配列を含む領域では遺伝子の欠失が自発的に生じることが判明しており[24]、また哺乳類細胞では、このような配列は染色体の二本鎖切断による巨大なゲノム断片の欠失を生じさせることが判明している。これらの遺伝的変化は白血病やリンパ腫といったがんでみられる染色体転座と関係しており、腫瘍細胞でみられる切断領域はZ-DNA形成配列の周辺にプロットされる。細菌のプラスミドでみられるような小さな欠失は複製の際のすべり(replication slippage)と関係している一方、哺乳類細胞でみられるようなより大きな欠失は、エラーが起こりやすい非相同末端結合過程によって引き起こされる[23][24]。
臭化エチジウムのトリパノソーマに対する毒性は、キネトプラストDNAがZ型へシフトすることによって引き起こされる。このシフトは臭化エチジウムのインターカレーションと、その後のDNA構造のゆるみによって引き起こされ、DNAの巻き戻し、Z型へのシフト、DNA複製の阻害が引き起こされる[25]。
Zαドメイン
[編集]Alan Herbertによって開発されたアプローチを用いて、Z-DNAへ高親和性で結合するドメイン(Zαドメイン)がADAR1中に発見された[26][27]。結晶学とNMRによる研究によって、このドメインは配列非特異的にZ-DNAに結合するという生化学的知見が裏付けされた[28][29][30]。配列の相同性に基づいて、関連するドメインが他の多数のタンパク質中に同定された[27]。同定されたZαドメインは新たな実験的ツールとして利用され、結晶学的研究によってZ-RNAやB-Zジャンクションの特性解析が行われた。ADAR1のZ-DNA結合ドメインは、新生RNAの配列修飾を行うこの酵素を、活発な転写が行われている部位へ局在させる役割を持つ可能性が生物学的研究からは示唆されている[31][32]。Zαドメイン、 Z-DNA、Z-RNAはヒトではAluの侵入に対してゲノムを保護しており、そこからさらに二本鎖RNAに対する自然免疫応答の調節機構へ進化したと考えられている。Zαドメインの変異は、エカルディ・グティエール症候群など、インターフェロノパシー(interferonopathy)と総称されるインターフェロン関連疾患の原因となる[33][34]。
ワクシニアE3Lタンパク質
[編集]Z-DNAの研究が進むにつれ、Z-DNA構造はロンドン分散力と水素結合によってZ-DNA結合タンパク質と結合することが発見された[35]。Z-DNA結合タンパク質の例としては、ワクシニアウイルスのE3Lタンパク質がある。このタンパク質はE3L遺伝子の産物で、Z-DNAに結合する哺乳類タンパク質を模倣する[36][37]。E3Lタンパク質はZ-DNAに対する親和性を有するだけでなく、マウスではワクシニアウイルスのビルレンス強度にも関係していることが示されている。E3LのN末端領域はZαドメインに類似した配列から構成されており、アデノシンデアミナーゼZαドメインとも呼ばれる。一方C末端領域は二本鎖RNA結合モチーフから構成される[36]。MITのKimらによる研究によって、E3LのN末端をADAR1のZαドメインへの置換は、マウスにおけるウイルスのビルレンスにほぼ影響を与えないことが示された。この置換によって約50アミノ酸が変化したが、Z-DNA結合残基を含む14残基は同一であった。一方、E3LのN末端の83残基全てを欠失させると、ビルレンスは低下した[36]。これらのことは、E3LのN末端とZαドメインの類似したZ-DNA結合残基はワクシニアウイルスのビルレンスを決定する最も重要な構造的因子である一方、Z-DNAの結合に関与していないアミノ酸残基はほぼ影響がないことを示している。またこれらは、ワクシニアウイルスを含むワクチン中のE3LのZ-DNAへの結合を低下させることで、ウイルスに対する有害反応の最小化を行える可能性を示唆している[36]。
さらにアレクサンダー・リッチとJin-Ah Kwonは、E3LがヒトのIL-6、NFAT、p53遺伝子のトランス活性化因子として機能することを発見した。彼らは、E3Lを含むHeLa細胞ではIL-6、NFAT、p53遺伝子の発現が増大し、特定のZ-DNA結合残基の点変異や欠失によってその発現が低下することを示した。特にTyr48とPro63の変異では、E3LとZ-DNAとの間の水素結合とロンドン分散力の喪失によってトランス活性化が低下することが判明した[35]。これらの結果は、Z-DNAとZ-DNA結合タンパク質の間の結合や相互作用の減少によってビルレンスと遺伝子発現の双方が低下することを示しており、これらの結合の重要性を示している。
DNA二重らせんの形状比較
[編集]

| A型 | B型 | Z型 | |
|---|---|---|---|
| らせんの巻き方 | 右巻き | 右巻き | 左巻き |
| 反復単位 | 1 bp | 1 bp | 2 bp |
| 1塩基対ごとの回転 | 32.7° | 34.3° | 30° |
| らせん1回転当たりの平均塩基対数 | 11 | 10 | 12 |
| らせん軸に対する塩基対の傾き | +19° | −1.2° | −9° |
| らせん軸に沿った塩基対間距離(rise/bp along axis) | 2.3 Å (0.23 nm) | 3.32 Å (0.332 nm) | 3.8 Å (0.38 nm) |
| らせん1回転当たりの距離(rise/turn of helix) | 28.2 Å (2.82 nm) | 33.2 Å (3.32 nm) | 45.6 Å (4.56 nm) |
| 塩基対の平均プロペラねじれ角(propeller twist) | +18° | +16° | 0° |
| グリコシド結合の結合角 | anti | anti | C: anti, G: syn |
| 糖の立体配座(sugar pucker) | C3′-endo | C2′-endo | C: C2′-endo, G: C3′-endo |
| らせんの直径 | 23 Å (2.3 nm) | 20 Å (2.0 nm) | 18 Å (1.8 nm) |
出典
[編集]- ^ Mitsui, Y.; Langridge, R.; Shortle, B. E.; Cantor, C. R.; Grant, R. C.; Kodama, M.; Wells, R. D. (1970). “Physical and enzymatic studies on poly d(I–C)·poly d(I–C), an unusual double-helical DNA”. Nature 228 (5277): 1166–1169. doi:10.1038/2281166a0. PMID 4321098.
- ^ Pohl, F. M.; Jovin, T. M. (1972). “Salt-induced co-operative conformational change of a synthetic DNA: equilibrium and kinetic studies with poly(dG-dC)”. Journal of Molecular Biology 67 (3): 375–396. doi:10.1016/0022-2836(72)90457-3. PMID 5045303.
- ^ Thamann, T. J.; Lord, R. C.; Wang, A. H.; Rich, A. (1981). “High salt form of poly(dG–dC)·poly(dG–dC) is left handed Z-DNA: raman spectra of crystals and solutions”. Nucleic Acids Research 9 (20): 5443–5457. doi:10.1093/nar/9.20.5443. PMC 327531. PMID 7301594.
- ^ Wang, A. H.; Quigley, G. J.; Kolpak, F. J.; Crawford, J. L.; van Boom, J. H.; van der Marel, G.; Rich, A. (1979). “Molecular structure of a left-handed double helical DNA fragment at atomic resolution”. Nature 282 (5740): 680–686. Bibcode: 1979Natur.282..680W. doi:10.1038/282680a0. PMID 514347.
- ^ a b Ha, S. C.; Lowenhaupt, K.; Rich, A.; Kim, Y. G.; Kim, K. K. (2005). “Crystal structure of a junction between B-DNA and Z-DNA reveals two extruded bases”. Nature 437 (7062): 1183–1186. Bibcode: 2005Natur.437.1183H. doi:10.1038/nature04088. PMID 16237447.
- ^ Hall, K.; Cruz, P.; Tinoco, I., Jr; Jovin, T. M.; van de Sande, J. H. (Oct 1984). “'Z-RNA'—a left-handed RNA double helix”. Nature 311 (5986): 584–586. Bibcode: 1984Natur.311..584H. doi:10.1038/311584a0. PMID 6482970.
- ^ Placido, D.; Brown, B. A., II; Lowenhaupt, K.; Rich, A.; Athanasiadis, A. (2007). “A left-handed RNA double helix bound by the Zalpha domain of the RNA-editing enzyme ADAR1”. Structure 15 (4): 395–404. doi:10.1016/j.str.2007.03.001. PMC 2082211. PMID 17437712.
- ^ de Rosa, M.; de Sanctis, D.; Rosario, A. L.; Archer, M.; Rich, A.; Athanasiadis, A.; Carrondo, M. A. (May 2010). “Crystal structure of a junction between two Z-DNA helices”. Proceedings of the National Academy of Sciences 107 (20): 9088–9092. Bibcode: 2010PNAS..107.9088D. doi:10.1073/pnas.1003182107. PMC 2889044. PMID 20439751.
- ^ Zhang, H.; Yu, H.; Ren, J.; Qu, X. (2006). “Reversible B/Z-DNA transition under the low salt condition and non-B-form poly(dA)poly(dT) selectivity by a cubane-like europium-L-aspartic acid complex”. Biophysical Journal 90 (9): 3203–3207. Bibcode: 2006BpJ....90.3203Z. doi:10.1529/biophysj.105.078402. PMC 1432110. PMID 16473901.
- ^ Ho, P. S.; Ellison, M. J.; Quigley, G. J.; Rich, A. (1986). “A computer aided thermodynamic approach for predicting the formation of Z-DNA in naturally occurring sequences”. EMBO Journal 5 (10): 2737–2744. doi:10.1002/j.1460-2075.1986.tb04558.x. PMC 1167176. PMID 3780676.
- ^ a b Champ, P. C.; Maurice, S.; Vargason, J. M.; Camp, T.; Ho, P. S. (2004). “Distributions of Z-DNA and nuclear factor I in human chromosome 22: a model for coupled transcriptional regulation”. Nucleic Acids Research 32 (22): 6501–6510. doi:10.1093/nar/gkh988. PMC 545456. PMID 15598822.
- ^ Wang, Andrew H.-J.; Quigley, Gary J.; Kolpak, Francis J.; Crawford, James L.; van Boom, Jacques H.; van der Marel, Gijs; Rich, Alexander (December 1979). “Molecular structure of a left-handed double helical DNA fragment at atomic resolution”. Nature 282 (5740): 680–686. doi:10.1038/282680a0. ISSN 0028-0836. PMID 514347.
- ^ a b Lee, Juyong; Kim, Yang-Gyun; Kim, Kyeong Kyu; Seok, Chaok (2010-08-05). “Transition between B-DNA and Z-DNA: Free Energy Landscape for the B−Z Junction Propagation”. The Journal of Physical Chemistry B 114 (30): 9872–9881. doi:10.1021/jp103419t. ISSN 1520-6106.
- ^ a b c d Kim, Sook Ho; Lim, So-Hee; Lee, Ae-Ree; Kwon, Do Hoon; Song, Hyun Kyu; Lee, Joon-Hwa; Cho, Minhaeng; Johner, Albert et al. (2018-03-23). “Unveiling the pathway to Z-DNA in the protein-induced B–Z transition”. Nucleic Acids Research 46 (8): 4129–4137. doi:10.1093/nar/gky200. ISSN 0305-1048. PMC 5934635. PMID 29584891.
- ^ Herbert, A.; Alfken, J.; Kim, Y.-G.; Mian, I. S.; Nishikura, K.; Rich, A. (1997-08-05). “A Z-DNA binding domain present in the human editing enzyme, double-stranded RNA adenosine deaminase”. Proceedings of the National Academy of Sciences 94 (16): 8421–8426. doi:10.1073/pnas.94.16.8421. ISSN 0027-8424. PMC 22942. PMID 9237992.
- ^ Herbert, A. (2019). “Mendelian disease caused by variants affecting recognition of Z-DNA and Z-RNA by the Zα domain of the double-stranded RNA editing enzyme ADAR.”. European Journal of Human Genetics 8: 114–117. doi:10.1038/s41431-019-0458-6. PMC 6906422. PMID 31320745.
- ^ Herbert, A. (2019). “ADAR and Immune Silencing in Cancer.”. Trends in Cancer 5 (5): 272-282. doi:10.1016/j.trecan.2019.03.004. PMID 31174840.
- ^ a b Suram, Anitha; Rao, K. S. Jagannatha; Latha, K. S.; Viswamitra, M. A. (2002). “First evidence to show the topological change of DNA from B-dNA to Z-DNA conformation in the hippocampus of Alzheimer's brain”. Neuromolecular Medicine 2 (3): 289–297. doi:10.1385/nmm:2:3:289. ISSN 1535-1084. PMID 12622407.
- ^ Lafer, E M; Valle, R P; Möller, A; Nordheim, A; Schur, P H; Rich, A; Stollar, B D (1983-02-01). “Z-DNA-specific antibodies in human systemic lupus erythematosus.”. Journal of Clinical Investigation 71 (2): 314–321. doi:10.1172/jci110771. ISSN 0021-9738. PMC 436869. PMID 6822666.
- ^ Rich, A; Zhang, S (2003). “Timeline: Z-DNA: the long road to biological function”. Nature Reviews Genetics 4 (7): 566–572. doi:10.1038/nrg1115. PMID 12838348.
- ^ Wittig, B.; Dorbic, T.; Rich, A. (1991). “Transcription is associated with Z-DNA formation in metabolically active permeabilized mammalian cell nuclei”. Proceedings of the National Academy of Sciences 88 (6): 2259–2263. Bibcode: 1991PNAS...88.2259W. doi:10.1073/pnas.88.6.2259. PMC 51210. PMID 2006166.
- ^ Wong, B.; Chen, S.; Kwon, J.-A.; Rich, A. (2007). “Characterization of Z-DNA as a nucleosome-boundary element in yeast Saccharomyces cerevisiae”. Proceedings of the National Academy of Sciences 104 (7): 2229–2234. Bibcode: 2007PNAS..104.2229W. doi:10.1073/pnas.0611447104. PMC 1892989. PMID 17284586.
- ^ a b Wang, G.; Christensen, L. A.; Vasquez, K. M. (2006). “Z-DNA-forming sequences generate large-scale deletions in mammalian cells”. Proceedings of the National Academy of Sciences 108 (8): 2677–2682. Bibcode: 2006PNAS..103.2677W. doi:10.1073/pnas.0511084103. PMC 1413824. PMID 16473937.
- ^ a b Freund, A. M.; Bichara, M.; Fuchs, R. P. (1989). “Z-DNA-forming sequences are spontaneous deletion hot spots”. Proceedings of the National Academy of Sciences 86 (19): 7465–7469. Bibcode: 1989PNAS...86.7465F. doi:10.1073/pnas.86.19.7465. PMC 298085. PMID 2552445.
- ^ Roy Chowdhury, A.; Bakshi, R.; Wang, J.; Yıldırır, G.; Liu, B.; Pappas-Brown, V.; Tolun, G.; Griffith, J. D. et al. (Dec 2010). “The killing of African trypanosomes by ethidium bromide”. PLoS Pathogens 6 (12): e1001226. doi:10.1371/journal.ppat.1001226. PMC 3002999. PMID 21187912.
- ^ Herbert, A.; Rich, A. (1993). “A method to identify and characterize Z-DNA binding proteins using a linear oligodeoxynucleotide”. Nucleic Acids Research 21 (11): 2669–2672. doi:10.1093/nar/21.11.2669. PMC 309597. PMID 8332463.
- ^ a b Herbert, A.; Alfken, J.; Kim, Y. G.; Mian, I. S.; Nishikura, K.; Rich, A. (1997). “A Z-DNA binding domain present in the human editing enzyme, double-stranded RNA adenosine deaminase.”. Proceedings of the National Academy of Sciences 94 (16): 8421–8426. Bibcode: 1997PNAS...94.8421H. doi:10.1073/pnas.94.16.8421. PMC 22942. PMID 9237992.
- ^ Herbert, A.; Schade, M.; Lowenhaupt, K.; Alfken, J; Schwartz, T.; Shlyakhtenko, L. S.; Lyubchenko, Y. L.; Rich, A. (1998). “The Zα domain from human ADAR1 binds to the Z-DNA conformer of many different sequences”. Nucleic Acids Research 26 (15): 2669–2672. doi:10.1093/nar/26.15.3486. PMC 147729. PMID 9671809.
- ^ Schwartz, T.; Rould, M. A.; Lowenhaupt, K.; Herbert, A.; Rich, A. (1999). “Crystal structure of the Zα domain of the human editing enzyme ADAR1 bound to left-handed Z-DNA”. Science 284 (5421): 1841–1845. doi:10.1126/science.284.5421.1841. PMID 10364558.
- ^ Schade, M.; Turner, C. J.; Kühne, R.; Schmieder, P.; Lowenhaupt, K.; Herbert, A.; Rich, A.; Oschkinat, H (1999). “The solution structure of the Zα domain of the human RNA editing enzyme ADAR1 reveals a prepositioned binding surface for Z-DNA”. Proceedings of the National Academy of Sciences 96 (22): 2465–2470. Bibcode: 1999PNAS...9612465S. doi:10.1073/pnas.96.22.12465. PMC 22950. PMID 10535945.
- ^ Herbert, A.; Rich, A. (2001). “The role of binding domains for dsRNA and Z-DNA in the in vivo editing of minimal substrates by ADAR1”. Proceedings of the National Academy of Sciences 98 (21): 12132–12137. Bibcode: 2001PNAS...9812132H. doi:10.1073/pnas.211419898. PMC 59780. PMID 11593027.
- ^ Halber, D. (1999年9月11日). “Scientists observe biological activities of 'left-handed' DNA”. MIT News Office. 2008年9月29日閲覧。
- ^ Herbert, A. (2019). “Z-DNA and Z-RNA in human disease”. Communications Biology 2: 7. doi:10.1038/s42003-018-0237-x. PMC 6323056. PMID 30729177.
- ^ Herbert, A. (2019). “Mendelian disease caused by variants affecting recognition of Z-DNA and Z-RNA by the Zα domain of the double-stranded RNA editing enzyme ADAR.”. European Journal of Human Genetics 8: 114–117. doi:10.1038/s41431-019-0458-6. PMC 6906422. PMID 31320745.
- ^ a b Kwon, J.-A.; Rich, A. (2005-08-26). “Biological function of the vaccinia virus Z-DNA-binding protein E3L: Gene transactivation and antiapoptotic activity in HeLa cells”. Proceedings of the National Academy of Sciences 102 (36): 12759–12764. doi:10.1073/pnas.0506011102. ISSN 0027-8424.
- ^ a b c d Kim, Y.-G.; Muralinath, M.; Brandt, T.; Pearcy, M.; Hauns, K.; Lowenhaupt, K.; Jacobs, B. L.; Rich, A. (2003-05-30). “A role for Z-DNA binding in vaccinia virus pathogenesis”. Proceedings of the National Academy of Sciences 100 (12): 6974–6979. doi:10.1073/pnas.0431131100. ISSN 0027-8424. PMC 165815. PMID 12777633.
- ^ Kim, Y.-G.; Lowenhaupt, K.; Oh, D.-B.; Kim, K. K.; Rich, A. (2004-02-02). “Evidence that vaccinia virulence factor E3L binds to Z-DNA in vivo: Implications for development of a therapy for poxvirus infection”. Proceedings of the National Academy of Sciences 101 (6): 1514–1518. doi:10.1073/pnas.0308260100. ISSN 0027-8424.
- ^ Sinden, Richard R. (1994). DNA Structure and Function (1st ed.). Academic Press. p. 398. ISBN 978-0-126-45750-6
- ^ Rich, A.; Norheim, A.; Wang, A. H. (1984). “The chemistry and biology of left-handed Z-DNA”. Annual Review of Biochemistry 53 (1): 791–846. doi:10.1146/annurev.bi.53.070184.004043. PMID 6383204.
- ^ Ho, P. S. (1994-09-27). “The non-B-DNA structure of d(CA/TG)n does not differ from that of Z-DNA”. Proceedings of the National Academy of Sciences 91 (20): 9549–9553. Bibcode: 1994PNAS...91.9549H. doi:10.1073/pnas.91.20.9549. PMC 44850. PMID 7937803.
