(E)-スチルベン
| (E)-スチルベン | |
|---|---|

| |

| |
別称 Bibenzylidene trans-α,β-Diphenylethylene (E)-1,2-Diphenylethylene ((1E)-2-Phenylvinyl)benzene trans-Stilbene [(E)-2-Phenylethenyl]benzene | |
| 識別情報 | |
| CAS登録番号 | 103-30-0 |
| PubChem | 638088 |
| ChemSpider | 553649 |
| UNII | 3FA7NW80A0 |
| EC番号 | 203-098-5 |
| 国連/北米番号 | 3077 |
| ChEBI | |
| ChEMBL | CHEMBL113028 |
| バイルシュタイン | 1616740 |
| Gmelin参照 | 4381 |
| |
| |
| 特性 | |
| 化学式 | C14H12 |
| モル質量 | 180.25 g mol−1 |
| 外観 | 固体 |
| 密度 | 0.9707 g/cm3 |
| 融点 |
122 ~ 125℃ |
| 沸点 |
305 ~ 307℃ |
| 水への溶解度 | 不溶 |
| 危険性 | |
| 安全データシート(外部リンク) | External MSDS |
| NFPA 704 | |
| 引火点 | 112 °C (234 °F; 385 K) |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
(E)-スチルベン(英語: (E)-Stilbene)または、trans-スチルベン(英語: trans-stilbene)は、構造式が C
6H
5CH=CHC
6H
5 で表される有機化合物である。ジアリールエテンに分類され、炭素-炭素二重結合の両端にフェニル基が1つずつ置換したエチレン部分を中心に持つ。(E)またはtransは、フェニル基が二重結合の反対側にあることを意味し、同じ方向にあるのは(Z)-スチルベン(cis-スチルベン)である。(E)-スチルベンは室温で白色の結晶性固体であり光化学的に(Z)-スチルベンに変換することができ、さらに反応させてフェナントレンを生成する。
スチルベンは、1843年にフランスの化学者オーギュスト・ローランによって発見された[2]。スチルベン」という名前は、この化合物の光沢のある外観から、ギリシャ語で「私は輝く」を意味するστίλβω(stilbo) に由来する。「スチルベン」の名はギリシャ語で光るを意味するστίλβωに由来する[3][4]。
異性体
[編集]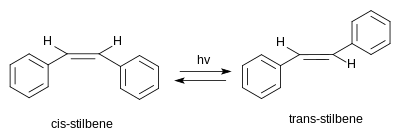
スチルベンには2つの異性体が存在する。1つはtrans-1,2-ジフェニルエチレンで、(E)-スチルベンまたはtrans-スチルベンと呼ばれる。もう1つはcis-1,2-ジフェニルエチレンで、(Z)-スチルベンまたはcis-スチルベンと呼ばれ、立体的な相互作用によって芳香環が面外に追いやられ、共役系を妨げるため、立体障害を受けて安定性が低下する[5]。cis-スチルベンは室温で液体(融点:5~6℃)であるのに対し、trans-スチルベンは125℃付近まで融解しない結晶性固体であり、2つの異性体の物理的性質が大きく異なることを示している[6][7]。
性質と反応
[編集]多くの合成法が開発されている。よく使われる方法の一つは、亜鉛アマルガムを使ったベンゾインの還元である[7]。
- C6H5–CH(OH)–C(=O)–C6H5 trans-C6H5–CH=CH–C6H5
スチルベンの両異性体は、α-フェニル桂皮酸の脱炭酸によって製造することができ、trans-スチルベンは、この酸の(Z)異性体から合成される[6]。
リチャード・ヘック[8]と溝呂木勉[9]は、パラジウム(II)触媒を用いたヨードベンゼンとスチレンのカップリングによるtrans-スチルベンの合成を、現在では溝呂木・ヘック反応として知られている方法で、それぞれ独立に報告している[10][11]。溝呂木によるアプローチの方が収率は高い。

スチルベンはアルケンの典型的な反応を受ける。trans-スチルベンは、過リン酸 (H
3PO
5) でエポキシ化され、ジオキサン中で74%の収率でTrans-スチルベンオキシドを生成する[12]。生成したエポキシド生成物は、1,2-ジフェニルオキシランの2つのエナンチオマーのラセミ体である。アキラルなメソ化合物(1R,2S)-1,2-ジフェニルオキシランはcis-スチルベンから生成するが、cis-体のペルオキシドエポキシド化ではcis-とtrans-の両方のエポキシド生成物が生じる。例えば、tert-ブチルヒドロペルオキシドを用いてcis-スチルベンを酸化すると、0.8%のcis-スチルベンオキシド、13.5%のtrans-スチルベンオキシド、6.1%のベンズアルデヒドが生成する[13][14]。エナンチオピュアなスチルベンオキシドは、ノーベル賞受賞者のバリー・シャープレスによって合成された[15]。

スチルベンは、オゾン分解[16]またはレミュー・ジョンソン酸化によってベンズアルデヒドに酸化することができ、酸性過マンガン酸カリウムのような強力な酸化剤では安息香酸を生成する。ビシナルジオールは、アップジョンジヒドロキシ化またはエナンチオ選択的にシャープレス不斉ジヒドロキシ化[17][18]を用いて合成することができ、鏡像体過剰率は100%に達する[19][20][21]。
trans-スチルベンを臭素化すると、典型的な求電子的臭素付加反応の環状ブロモニウムイオン中間体が関与する機構に沿って、主にmeso-1,2-ジブロモ-1,2-ジフェニルエタン(meso-スチルベンジブロミドと呼ばれることもある)が生成する[22]。cis-スチルベンは、四塩化炭素のような非極性溶媒中では1,2-ジブロモ-1,2-ジフェニルエタンの2つのエナンチオマーのラセミ体を生成するが、メソ化合物の生成の程度は溶媒の極性とともに増加し、ニトロメタン中での収率は90%である[23]。 trans体からスチルベンジブロミドの2つのエナンチオマーが少量生成することから、ブロモニウムイオン中間体が、どちらの面からも求核攻撃を受けやすい空孔のp軌道を持つカルボカチオン中間体 PhCHBr–C+(H)Ph と化学平衡状態にあることが示唆される[22]。誘電率が35を超える溶媒であっても、臭化物塩または三臭化物塩を加えることで立体特異性の多くが回復する[24]。
紫外線を照射すると、シス–トランス異性化を伴う光化学反応の典型例であるcis-スチルベンに変換し、さらに反応を経てフェナントレンになる[25]。

誘導体と用途
[編集]合成
[編集](E)-スチルベン自体にはほとんど価値がないが、染料、蛍光増白剤、蛍光体、シンチレーターとして使用される誘導体の前駆体である[26]。スチルベンは、色素レーザーで使用される利得媒質の一つである[27]。

4,4'-ジニトロスチルベン-2,2'-ジスルホン酸二ナトリウムは、4-ニトロトルエンのスルホン化によって合成され、4-ニトロトルエン-2-スルホン酸を形成し、次亜塩素酸ナトリウムを用いて酸化的にカップリングさせることにより(E)-スチルベン誘導体を合成することができる[28]。これは19世紀後半にアーサー・ジョージ・グリーンとアンドレ・ワールによって開発されたプロセスである[29][30]。液体アンモニア中での空気酸化を用いた、より高い収率を伴うプロセスが開発されている[31]。この生成物は、アニリン誘導体との反応によってアゾ染料が形成されるため有用である。この化合物から得られる商業的に重要な染料には、ダイレクトレッド76、ダイレクトブラウン78、ダイレクトオレンジ40などがある[27]。
天然のスチルベン
[編集]
スチルベノイドとは天然に存在するスチルベン誘導体である。例えば、レスベラトロールやその類似化合物のプテロスチルベンなどがある。(E)-スチルベンと構造的には似ているが、合成学的には関連していないスチルベストロールは、エストロゲン活性を示す。このグループには、ジエチルスチルベストロール、ホスフェストロール、およびジエネストロールが含まれる。このような誘導体の一部は、ケイ皮酸またはp-クマル酸とマロン酸の補酵素A誘導体の縮合によって生成される。
付録
[編集]表1. 蒸気圧[32]
| 異性体 | 温度, °C | 蒸気圧, kPa |
|---|---|---|
| cis-スチルベン | 100 | 0.199 |
| cis-スチルベン | 125 | 0.765 |
| cis-スチルベン | 150 | 2.51 |
| trans-スチルベン | 150 | 0.784 |
出典
[編集]- ^ a b International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. pp. 379. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4
- ^ Laurent, Auguste (1843). “Mémoire sur la série stilbique [Memoir on the stilbene series]” (French). Comptes rendus 16: 856–860. From p. 857: "En soumettant ce sulfure à la distillation, il donne plusieurs produits, et entre autres, un composé fort remarquable que je nomme stilbène." (On submitting this sulfide [i.e., phenyl thioaldehyde, C6H5(CS)H] to [dry] distillation, it gives several products, and among others, a very remarkable compound which I name "stilbene".)
- ^ Oxford Dictionary of English, 2003.
- ^ Miller, William Allen (1880). Elements of Chemistry: Theoretical and Practical. 3 (5th ed.). London, England: Longmans, Green and Co.. p. 366
- ^ Eliel, Ernest L.; Wilen, Samuel H. (1994). Stereochemistry of Organic Compounds. John Wiley and Sons. pp. 566-567. ISBN 0-471-01670-5
- ^ a b Buckles, Robert E.; Wheeler, Norris G. (1953). "cis-Stilbene". Organic Syntheses (英語). 33: 88. doi:10.15227/orgsyn.033.0088。; Collective Volume, vol. 4, p. 857
- ^ a b Shriner, R. L.; Berger, Alfred (1943). "trans-Stilbene". Organic Syntheses (英語). 23: 86. doi:10.15227/orgsyn.023.0086。; Collective Volume, vol. 3, p. 786
- ^ Heck, R. F.; Nolley, J. P. (1972). “Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides”. J. Org. Chem. 37 (14): 2320–2322. doi:10.1021/jo00979a024.
- ^ Mizoroki, Tsutomu; Mori, Kunio; Ozaki, Atsumu (1971). “Arylation of Olefin with Aryl Iodide Catalyzed by Palladium”. Bull. Chem. Soc. Jpn. 44 (2): 581. doi:10.1246/bcsj.44.581.
- ^ Heck, Richard F. (1982). “Palladium-Catalyzed Vinylation of Organic Halides”. Organic Reactions. 27. pp. 345–390. doi:10.1002/0471264180.or027.02. ISBN 0471264180
- ^ Beletskaya, Irina P.; Cheprakov, Andrei V. (2000). “The Heck Reaction as a Sharpening Stone of Palladium Catalysis”. Chem. Rev. 100 (8): 3009–3066. doi:10.1021/cr9903048. PMID 11749313.
- ^ Ogata, Yoshiro; Tomizawa, Kohtaro; Ikeda, Toshiyuki (1979). “Oxidation of trans-stilbene with peroxymonophosphoric acid”. J. Org. Chem. 44 (14): 2362–2364. doi:10.1021/jo01328a006.
- ^ Yin, Guochuan; Danby, Andrew M.; Kitko, David; Carter, John D.; Scheper, William M.; Busch, Daryle H. (2007). “Olefin Epoxidation by Alkyl Hydroperoxide with a Novel Cross-Bridged Cyclam Manganese Complex: Demonstration of Oxygenation by Two Distinct Reactive Intermediates”. Inorg. Chem. 46 (6): 2173–2180. doi:10.1021/ic061957r. PMID 17295471.
- ^ Busch, Daryle H.; Yin, Guochuan; Less, Hyun-Jin (2011). “Lewis Acid Catalyzed Epoxidation of Olefins Using Hydrogen Peroxide: Growing Prominence and Expanding Range”. In Oyama, S. Ted. Mechanisms in Homogeneous and Heterogeneous Epoxidation Catalysis. Elsevier. pp. 119–153. ISBN 9780080558011
- ^ Chang, Han-Ting; Sharpless, K. Barry (1996). “Molar Scale Synthesis of Enantiopure Stilbene Oxide”. J. Org. Chem. 61 (18): 6456–6457. doi:10.1021/jo960718q. PMID 11667495.
- ^ Bishop, Clyde E.; Denson, Donald D.; Story, Paul R. (1968). “Mechanisms of ozonolysis. The cis, trans-stilbene system”. Tetrahedron Lett. 9 (55): 5739–5742. doi:10.1016/S0040-4039(00)76338-6.
- ^ Jacobsen, Eric N.; Marko, Istvan; Mungall, William S.; Schroeder, Georg; Sharpless, K. Barry (1988). “Asymmetric dihydroxylation via ligand-accelerated catalysis”. J. Am. Chem. Soc. 110 (6): 1968–1970. doi:10.1021/ja00214a053.
- ^ Kolb, Hartmuth C.; VanNieuwenhze, Michael S.; Sharpless, K. Barry (1994). “Catalytic Asymmetric Dihydroxylation”. Chem. Rev. 94 (8): 2483–2547. doi:10.1021/cr00032a009.
- ^ Wang, Zhi-Min; Sharpless, K. Barry (1994). “A Solid-to-Solid Asymmetric Dihydroxylation Procedure for Kilogram-Scale Preparation of Enantiopure Hydrobenzoin”. J. Org. Chem. 59 (26): 8302–8303. doi:10.1021/jo00105a065.
- ^ McKee, Blaine H.; Gilheany, Declan G.; Sharpless, K. Barry (1992). "(R,R)-1,2-Diphenyl-1,2-ethanediol (Stilbene Diol)". Organic Syntheses (英語). 70: 47. doi:10.15227/orgsyn.070.0047。; Collective Volume, vol. 9, p. 383
- ^ Atta-ur-Rahman; Shah, Zahir (1993). “Asymmetric Hydroxylations”. Stereoselectove Synthesis in Organic Chemistry. Springer-Verlag. pp. 406–410. ISBN 9781461383277
- ^ a b Gilbert, John C.; Martin, Stephen F. (2010). “10.6 – Bromination of Alkenes”. Experimental Organic Chemistry: A Miniscale and Microscale Approach (5th ed.). Cengage Learning. pp. 376–383. ISBN 9781439049143
- ^ Buckles, Robert E.; Bader, Jane M.; Thurmaier, Roland J. (1962). “Stereospecificity of the Addition of Bromine to cis- and trans-Stilbene”. J. Org. Chem. 27 (12): 4523–4527. doi:10.1021/jo01059a097.
- ^ Bianchini, Roberto; Chiappe, Cinzia (1992). “Stereoselectivity and reversibility of electrophilic bromine addition to stilbenes in chloroform: influence of the bromide-tribromide-pentabromide equilibrium in the counteranion of the ionic intermediates”. J. Org. Chem. 57 (24): 6474–6478. doi:10.1021/jo00050a021.
- ^ Kwasniewski, S. P.; Claes, L.; François, J.-P.; Deleuze, M. S. (2003). “High level theoretical study of the structure and rotational barriers of trans-stilbene”. J. Chem. Phys. 118 (17): 7823–7836. Bibcode: 2003JChPh.118.7823K. doi:10.1063/1.1563617.
- ^ Vogt, Peter F.; Gerulis, John J. (2000). "Amines, Aromatic". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_037. ISBN 3527306730。
- ^ a b Hunger, Klaus; Mischke, Peter; Rieper, Wolfgang; Raue, Roderich; Kunde, Klaus; Engel, Aloys (2000). "Azo Dyes". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a03_245. ISBN 3527306730。
- ^ Cumming, William M.; Hopper, I. Vance; Wheeler, T. Sherlock (1926). “Preparation 294.—Dinitro-Stilbene-Disulphonic Acid (Na salt)”. Systematic Organic Chemistry: Modern Methods of Preparation and Estimation. New York: D. Van Nostrand Company. p. 314
- ^ Green, Arthur G.; Wahl, André R. (1897). “Ueber die Oxydation von Paranitrotoluolsulfosäure [On the oxidation of para-nitrotoluenesulfonic acid]” (German). Ber. Dtsch. Chem. Ges. 30 (3): 3097–3101. doi:10.1002/cber.189703003128.
- ^ Green, Arthur G.; Wahl, André R. (1898). “Ueber die Oxydation der Paranitrotoluolsulfosäure [On the oxidation of para-nitrotoluenesulfonic acid]” (German). Ber. Dtsch. Chem. Ges. 31 (1): 1078–1080. doi:10.1002/cber.189803101195.
- ^ US patent 5041632, Guglielmetti, Leonardo, "Process for the preparation of 4,4'-dinitrostilbene-2,2-disulfonic acid", published 1991-08-20, issued 1991-08-20, assigned to Ciba-Geigy Corporation
- ^ Lide, David (1995). CRC Handbook of Chemistry and Physics (76th ed.). USA: CRC Press, Inc.. pp. 6–107. ISBN 0-8493-0476-8


![{\displaystyle {\ce {->[{\ce {Zn(Hg)}}][{\ce {HCl}}{\text{, }}{\ce {CH3CH2OH}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e1406e12754001b43f053ffef11d727e4d7de0e9)