金属カルボニル

5個の CO 配位子が鉄原子と結合している。
金属カルボニル(きんぞくカルボニル、英: metal carbonyl)は、一酸化炭素を配位子にもつ遷移金属錯体である。これにはニッケルカルボニル Ni(CO)4 のようなホモレプティックな(CO 配位子のみを含む)錯体があるが、一般的には金属カルボニルは Re(CO)3(2,2'-bipyridine)Cl のように複数の配位子をもつ。
一酸化炭素はヒドロホルミル化のような多くの化合物の合成における重要な原料であり、金属カルボニル触媒はその利用において中心的な位置を占める。ヘモグロビンと結合してカルボキシヘモグロビンを与え、ヘモグロビンを酸素と結合できなくさせる性質のため、金属カルボニルは有毒である[1]。
構造と性質
[編集]
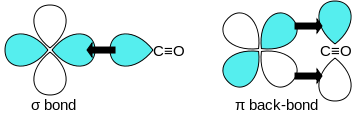
σ結合性 MO
π*反結合性MO
金属カルボニルは一般的に水に溶けにくい。
一酸化炭素はπ*逆供与結合で遷移金属と結合する。結合は3つの要素をもち、部分的な三重結合性を与える。σ結合は金属の s, p, d 軌道からなる混成軌道と、C 上の孤立電子対との重なりによって生じる。1対のπ結合はC から突き出た1対のπ*反結合性軌道と、金属の満たされたd軌道との重なりによって生じる。後者のπ結合は金属がd電子をもっており、比較的低い酸化状態 (<+2) にあることを必要とする。逆供与結合は遊離一酸化炭素と比較して C-O 結合を弱める働きをする。M-CO 結合の多重結合性のため、この結合長は< 1.8 Åと、金属-アルキル結合と比較して0.2 Åほど短い。
クラスターの結合モデル
[編集]カルボニル配位子は、金属カルボニルの化学における結合モデルの範囲に関与している[1][2]。最も多いのは上記のような末端 CO である。しかし、しばしば CO は2つ (μ2) または3つ (μ3) の金属間を架橋する。C と O がそれぞれ金属に結合しているようなモデル (μ3-η2) はそれほど一般的ではない。
複数の金属中心からのπ逆供与により増加したπ結合は、結果として C-O 結合をさらに弱めることになる。
特徴
[編集]| カルボニル化合物 | νCO (cm-1) |
|---|---|
| 2143 | |
| 1748 | |
| 1859 | |
| 2000 | |
| 2100 | |
| 2204 | |
| 2022, 2000 |
金属カルボニルを特徴づけるために最も重要な技術は赤外分光法である。CO 伸縮振動 (νCO) は CO ガス中で2143 cm-1である。金属カルボニルにおける νCO バンドは、M-CO 間のπ結合の強さと逆に相関する。
これらの振動数に加えて、νCO バンドの数は錯体の構造を推定する際に有用である。Cr(CO)6 のような八面体形錯体は、1本のみの赤外吸収バンドを与える。より対称性が低い錯体のスペクトルはより複雑になる。例えば Fe2(CO)9 は、2082, 2019, 1829 cm-1の位置で赤外吸収バンドを示す。
カルボニルクラスターにおいて、νCO バンドは CO の配位幾何構造のよい手掛かりである。架橋 (μ2) CO の νCO バンドは通常、末端 CO のものと比較して100-200 cm-1低波数側にシフトする。面冠 (μ3) CO の νCO バンドはさらに低波数側に現れる。ロジウムカルボニルクラスターの代表的な値は以下の通りである[3]。
| ロジウムカルボニル | νCO, µ1 (cm-1) | νCO, µ2 (cm-1) | νCO, µ3 (cm-1) |
|---|---|---|---|
| 2060, 2084 | 1846, 1862 | ||
| 2044, 2070, 2074 | 1886 | ||
| 2045, 2075 | 1819 |
合成
[編集]ニッケルカルボニルと鉄ペンタカルボニルは金属を一酸化炭素で処理することによって得られるが、大部分の金属カルボニルは直接合成されない。他のホモレプティックな金属カルボニルは、通常オートクレーブ中の高圧一酸化炭素のもとで、金属塩または金属酸化物を“還元カルボニル化”することによって得られる。
これらのホモレプティックカルボニルは合成されたのちに、長い置換反応と酸化還元反応を経る。
ルテニウム、オスミウム、ロジウム、イリジウムの混合配位子カルボニルは、しばしばジメチルホルムアミド (DMF) や2-メトキシエタノールのような溶媒中で CO を除去することによって得られる。代表例には、熱 DMF 溶液中の塩化イリジウム(III)とトリフェニルホスフィンとの反応による IrCl(CO)(PPh3)2 の合成がある。
自然における発生
[編集]ヒドロゲナーゼ酵素は鉄と結合した CO を含む。この CO は水素との結合を促進させる、低い酸化状態を安定化させていると考えられている[4]。痕跡量の金属カルボニルが、これらの形成環境に矛盾しない還元性環境の埋立地で計測された[5]。
化合物
[編集]大部分の金属カルボニル錯体は複数の配位子をもっている。例として、歴史的に重要な IrCl(CO)(P(C6H5)3)2 や、アンチノック剤である (CH3C5H4)Mn(CO)3 がある。これらの混合配位子錯体の多くの親化合物は、化学式が [M(CO)n]z と表される二元カルボニル化合物である。これらの多くは市販されている。多くの金属カルボニルの化学式は18電子則から推測することができる。
電気的中性な二元金属カルボニル
[編集]- 4個の価電子をもつ第4族元素の金属カルボニルは珍しいが、Ti(CO)7 の置換誘導体が知られている。
- 5個の価電子をもつ第5族元素の金属カルボニルは V(CO)6 がよく知られているが、V2(CO)12 のような M-M 結合をもつ種の形成は、立体化学的な影響によって妨げられるため知られていない。
- 6個の価電子をもつ第6族元素の金属カルボニルには Cr(CO)6、Mo(CO)6、W(CO)6 (6 + 2x6 = 18 電子) などがある。ヘキサカルボニルシーボーギウム(Sg(CO)6)は2014年に初めて合成に成功し、他の第6族元素のカルボニル錯体と似た性質であることが判明した[6]。
- 7個の価電子をもつ第7族元素の金属カルボニルには二量体である Mn2(CO)10、Tc2(CO)10、Re2(CO)10 (7 + 1 + 2x5 = 18 電子) などがある。
- 8個の価電子をもつ第8族元素の金属カルボニルには Fe(CO)5、Ru(CO)5、Os(CO)5 (8 + 2x5 = 18 電子) などがある。後ろ2つは不安定で、Ru3(CO)12、Os3(CO)12 を与えるために脱カルボニル化する傾向がある。鉄の他の主要な金属カルボニルには Fe3(CO)12 、Fe2(CO)9 がある。
- 9個の価電子をもつ第9族元素の金属カルボニルは二量体 M2(CO)8 をつくる。実際、コバルトオクタカルボニルが唯一安定な単量体である。しかし四量体はよく知られている:Co4(CO)12、Rh4(CO)12、Rh6(CO)16、Ir4(CO)12 (9 + 3 + 2x3 = 18 電子) 大部分の18電子の金属カルボニルと違い、Co2(CO)8 は酸素に敏感である。
- 10個の価電子をもつ第10族元素の金属カルボニルには Ni(CO)4 (10 + 2x4 = 18 電子) がある。奇妙なことに Pd(CO)4 と Pt(CO)4 は安定ではない。
アニオン性二元金属カルボニル
[編集]- 第4族元素の金属カルボニルのジアニオンは中性の第6族カルボニルに類似している:[Ti(CO)6]2-[7]
- 第5族元素の金属カルボニルのモノアニオンも中性の第6族カルボニルに類似している:[V(CO)6]-
- 第7族元素の金属カルボニルのモノアニオンは中性の第8族カルボニルに類似している:[M(CO)5]- (M = Mn, Tc, Re)
- 第8族元素の金属カルボニルのジアニオンは中性の第10族カルボニルに類似している:[M(CO)4]2- (M = Fe, Ru, Os) 縮合したものも知られている。
- 第9族元素の金属カルボニルのモノアニオンは中性の第10族カルボニルに類似している:[Co(CO)4]- は最も研究されている化合物である。
Ni、Pd、Pt の大きなアニオン性クラスターもよく知られている。
カチオン性二元金属カルボニル
[編集]- 第7族元素の金属カルボニルのモノカチオンは中性の第6族カルボニルに類似している:[M(CO)6]+ (M = Mn, Tc, Re)
- 第8族元素の金属カルボニルのジカチオンも中性の第6族カルボニルに類似している:[M(CO)6]2+ (M = Fe, Ru, Os)[8]
金属カルボニル水素化物
[編集]| 金属カルボニル水素化物 | pKa |
|---|---|
| HCo(CO)4 | "strong" |
| HCo(CO)3(P(OPh)3) | 5.0 |
| HCo(CO)3(PPh3) | 7.0 |
| HMn(CO)5 | 7.1 |
| H2Fe(CO)4 | 4.4, 14 |
| [HCo(dmgH)2PBu3 | 10.5 |
金属カルボニルは、負の酸化状態の錯体を形成するという点で特徴的である。これには上述のアニオンも含まれる。これらのアニオンは、対応する金属カルボニル水素化物を与えるためにプロトン化されることができる。中性の金属カルボニル水素化物はしばしば揮発性で、強酸性である[9]。
関連する化合物
[編集]多くの配位子が金属カルボニルに類似したホモレプティック錯体や、混合配位子錯体を形成することが知られている。
ニトロシル錯体
[編集]ニトロシル錯体ではホモレプティック錯体は知られていないが、主な配位子として NO を含むものは非常に多い。NO は CO と比較してより強いアクセプターであり、イソシアニドはよいドナーである。よく知られたニトロシルカルボニルには CoNO(CO)3 や Fe(NO)2(CO)2 がある[10]。
チオカルボニル錯体
[編集]CS を含んだ錯体は知られているが、まれである[11][12]。このような錯体の希少性は、1つには一硫化炭素が不安定であるという事実に起因している。そのためチオカルボニル錯体の合成には、テトラカルボニル鉄酸二ナトリウムとチオホスゲンとの反応のように、より複雑な合成ルートを必要とする。
CSe と CTe の錯体は非常にまれである。
ホスフィン錯体
[編集]すべての金属カルボニルは有機リン化合物配位子によって置換される。例えば、Fe(CO)5-x(PR3)x は x = 1, 2, 3 で様々なホスフィン配位子を含むものがよく知られている。PF3 も同様に振る舞うが、二元金属カルボニルのホモレプティックアナログを容易に形成するため、より注目に値する。例えば、揮発性の安定な錯体 Fe(PF3)5 と Co2(PF3)8 は、それぞれ Fe(CO)5 と Co2(CO)8(非架橋)の CO のないアナログに相当する。
イソシアニド錯体
[編集]イソシアニドも金属カルボニルに関連した広範囲にわたる錯体をつくる。代表的なイソシアニド配位子には、MeNC と Me3CNC がある。特殊な例は CF3NC で、不安定な分子が、金属カルボニルに対応して振る舞う安定な錯体を形成する。
歴史
[編集]ルードウィッヒ・モンドは1880年代にニッケルカルボニルを発見した。それは後に、最初の金属カルボニル水素化物 H2Fe(CO)4、最初の金属カルボニルハライド Fe(CO)4I2 を発見したヴァルター・ヒーバーによる多くのアナログの合成に至った。ヒーバーは最初の金属クラスターである Fe3(CO)12 における中心金属数という概念も確立した。金属触媒を用いるカルボニル化による経済的利益は、レッペ反応やヒドロホルミル化のように地域の成長につながった。
出典
[編集]- ^ a b Elschenbroich, C. ”Organometallics” (2006) Wiley-VCH: Weinheim. ISBN 3-527-29390-6
- ^ P. J. Dyson and J. S. McIndoe, Transition Metal Carbonyl Cluster Chemistry, Gordon & Breach: Amsterdam (2000). ISBN 9056992899.
- ^ A.D. Allian, Y. Wang, M. Saeys, G.M. Kuramshina, M. Garland (2006). “The combination of deconvolution and density functional theory for the mid-infrared vibrational spectra of stable and unstable rhodium carbonyl clusters”. Vibrational Spectroscopy 41: 101–111. doi:10.1016/j.vibspec.2006.01.013.
- ^ Bioorganometallics: Biomolecules, Labeling, Medicine; Jaouen, G., Ed. Wiley-VCH: Weinheim, 2006.3-527-30990-X.
- ^ Feldmann, J. (1999). “Determination of Ni(CO)4, Fe(CO)5, Mo(CO)6, and W(CO)6 in sewage gas by using cryotrapping gas chromatography inductively coupled plasma mass spectrometry”. Journal of Environmental Monitoring 1: 33–37. doi:10.1039/a807277i.
- ^ 106番元素シーボーギウム(Sg)のカルボニル錯体の合成に成功、理化学研究所、2014年9月19日、2018年12月23日閲覧
- ^ Ellis, J. E. (2003). “Metal Carbonyl Anions: from [Fe(CO)4]2- to [Hf(CO)6]2- and Beyond”. Organometallics 22: 3322–3338. doi:10.1021/om030105l.
- ^ Finze, M.; Bernhardt, E.; Willner, H.; Lehmann, C. W.; Aubke, F. (2005). “Homoleptic, σ-Bonded Octahedral Superelectrophilic Metal Carbonyl Cations of Iron(II), Ruthenium(II), and Osmium(II). Part 2: Syntheses and Characterizations of [M(CO)6][BF4]2 (M = Fe, Ru, Os)”. Inorg. Chem. 44 (12): 4206–4214. doi:10.1021/ic0482483. PMID 15934749.
- ^ Pearson, Ralph G. (1995). “The Transition-Metal-Hydrogen Bond”. Chem. Rev. 95: 41. doi:10.1021/cr00065a002.
- ^ Hayton, T. W.; Legzdins, P. and Sharp, W. B., "Coordination and Organometallic Chemistry of Metal-NO Complexes", Chemical Reviews, 2002, volume 102, 935-991.doi:10.1021/cr000074t
- ^ Petz, W., "40 years of transition-metal thiocarbonyl chemistry and the related CSe and CTe compounds", Coordination Chemistry Reviews, 2008, 252, 1689-1733.doi:10.1016/j.ccr.2007.12.011.
- ^ Hill, A. F.; Wilton-Ely, J. D. E. T. (2002). “Chlorothiocarbonyl-bis(triphenylphosphine) iridium(I) [IrCl(CS)(PPh3)2]”. Inorg. Synth. 33: 244–245. doi:10.1002/0471224502.ch4.