椎名ラクトン化反応
椎名ラクトン化反応(しいなラクトンかはんのう、英: Shiina lactonizationまたはShiina macrolactonization)とは有機化学における化学反応のひとつで、芳香族カルボン酸無水物を脱水縮合剤に用いたラクトンの合成法である。1994年にルイス酸触媒を用いる手法が[1][2]、2002年に求核性触媒を用いる手法が椎名勇によって報告された[3][4]。
機構
[編集]芳香族カルボン酸無水物と触媒の存在下、ヒドロキシカルボン酸を系内にゆっくり加えると、下図の過程を経て対応するラクトン(環状エステル)が得られる。酸性条件での椎名ラクトン化ではルイス酸触媒が用いられ、塩基性条件での椎名ラクトン化では求核性触媒が用いられる。
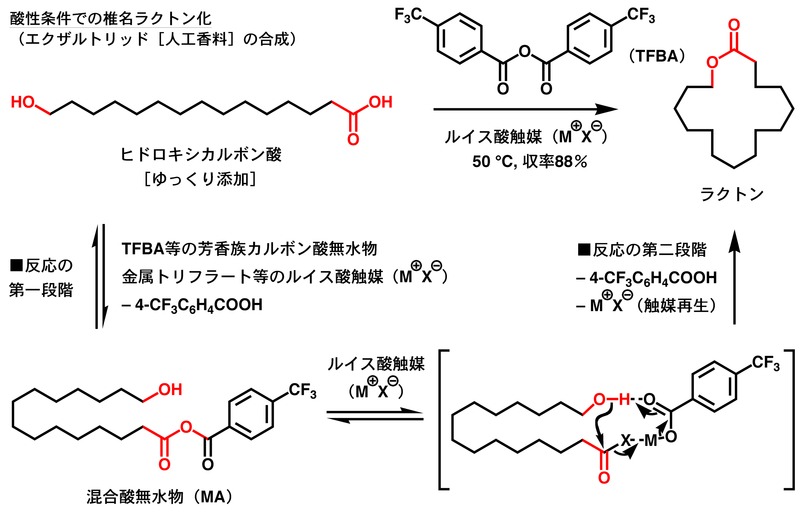
酸性条件の反応では、4-トリフルオロメチル安息香酸無水物(TFBA)が脱水縮合剤として主に利用される。まず、TFBAにルイス酸触媒が作用し、活性化されたTFBAにヒドロキシカルボン酸のカルボキシル基が反応することで混合酸無水物(Mixed Anhydride, MA)が一旦生成する。引き続き、MAに含まれるヒドロキシカルボン酸由来のカルボニル基が選択的に活性化を受け、ヒドロキシカルボン酸の水酸基が分子内求核攻撃する。同時に、MAから生じた芳香族カルボン酸残基が脱プロトン化剤として働くことで閉環反応が進行しラクトンを与える。反応の収支としては、TFBAが原料であるヒドロキシカルボン酸から水分子1個分の原子を奪い、自らは2分子の4-トリフルオロメチル安息香酸となって反応が終結する。ルイス酸触媒は反応の最後に再生するので原料よりも少ない量で足りる。

塩基性条件の反応では、2-メチル-6-ニトロ安息香酸無水物(MNBA)が脱水縮合剤として多用される[5]。まず、求核性触媒がMNBAに作用することで活性アシルカルボキシラートを与える。これに対してヒドロキシカルボン酸のカルボキシル基が反応することで、酸性条件の反応と同様にMAが一旦生成する。続いて、求核性触媒がMAに含まれるヒドロキシカルボン酸由来のカルボニル基に選択的に作用することで活性アシルカルボキシラートを再度与える。カルボニル基にヒドロキシカルボン酸の水酸基が分子内求核攻撃し、同時に、2-メチル-6-ニトロ安息香酸のカルボキシラートアニオンが脱プロトン化剤として働くことで閉環反応が進行しラクトンを与える。反応の収支としては、MNBAが原料から水分子1個分の原子を奪い、自らは2分子の2-メチル-6-ニトロ安息香酸のアミン塩となって反応が終結する。求核性触媒は反応の最後に再生するので原料よりも少ない量で足りる。
補足
[編集]椎名ラクトン化反応の過程は、最後の環化ステップ以外はすべて可逆反応で構成されている。反応の第一段階では穏やかな条件で速やかに混合酸無水物(MA)が生成し、次いで第二段階ではさらに高速なMAの環化反応が進行するためMA濃度の上昇が抑制される。この効果を最大限に引き出すために、原料であるヒドロキシカルボン酸はシリンジポンプを用いて系内にゆっくりと添加する。シリンジポンプを使用して少しずつ添加されるヒドロキシカルボン酸は、わずかに系内に投入された時点で全量が迅速にMAに変換され、引き続き直ちに環化して消費される。このように、椎名ラクトン化反応ではMAの濃度が反応初期から終了時まで全期間にわたり低く保たれるため、単量体の生成比が非常に高い。 芳香族カルボン酸無水物を脱水縮合剤とする反応はヒドロキシカルボン酸の分子内反応(椎名ラクトン化反応)のみならず、カルボン酸とアルコールの分子間反応にも使われる(椎名エステル化反応)。分子内反応、分子間反応ともに様々な天然物や薬理活性化合物の人工合成に利用されている[6][7]。カルボン酸とアミンの反応ではアミドやペプチドも得られる[8]。 酸性条件の反応では、金属トリフラートなどのルイス酸触媒が高活性であり、塩基性条件の反応では、N,N-ジメチル-4-アミノピリジン(DMAP)、N,N-ジメチル-4-アミノピリジン N-オキシド(DMAPO)および4-ピロリジノピリジン(PPY)などが用いられる。
脚注
[編集]- ^ Shiina, I.; Mukaiyama, T. (1994). “A Novel Method for the Preparation of Macrolides from ω-Hydroxycarboxylic Acids”. Chem. Lett. 23 (4): 677. doi:10.1246/cl.1994.677.
- ^ Shiina, I. (2004). “An Effective Method for the Synthesis of Carboxylic Esters and Lactones Using Substituted Benzoic Anhydrides with Lewis Acid Catalysts”. Tetrahedron 60 (7): 1587. doi:10.1016/j.tet.2003.12.013.
- ^ Shiina, I.; Kubota, M.; Ibuka, R. (2002). “A Novel and Efficient Macrolactonization of ω-Hydroxycarboxylic Acids Using 2-Methyl-6-nitrobenzoic Anhydride (MNBA)”. Tetrahedron Lett. 43 (42): 7535. doi:10.1016/S0040-4039(02)01819-1.
- ^ Shiina, I.; Kubota, M.; Oshiumi, H.; Hashizume, M. (2004). “An Effective Use of Benzoic Anhydride and Its Derivatives for the Synthesis of Carboxylic Esters and Lactones: A Powerful and Convenient Mixed Anhydride Method Promoted by Basic Catalysts”. J. Org. Chem. 69 (6): 1822.. doi:10.1021/jo030367x.
- ^ Shiina, I.; Umezaki, Y.; Kuroda, N.; Iizumi, T.; Nagai, S.; Katoh, T. (2012). “MNBA-Mediated β-Lactone Formation: Mechanistic Studies and Application for the Asymmetric Total Synthesis of Tetrahydrolipstatin”. J. Org. Chem. 77 (11): 4885.. doi:10.1021/jo300139r.
- ^ Shiina, I. (2007). “Total Synthesis of Natural 8- and 9-Membered Lactones: Recent Advancements in Medium-Sized Ring Formation”. Chem. Rev. 107 (1): 239. doi:10.1021/cr050045o.
- ^ Shiina, I. (2014). “An Adventurous Synthetic Journey with MNBA from Its Reaction Chemistry to the Total Synthesis of Natural Products”. Bull. Chem. Soc. Jpn. 87 (2): 196. doi:10.1246/bcsj.20130216.
- ^ Shiina, I.; Ushiyama, H.; Yamada, Y.; Kawakita, Y.; Nakata, K. (2008). “4-(Dimethylamino)pyridine N-oxide (DMAPO): an Effective Nucleophilic Catalyst in the Peptide Coupling Reaction with 2-Methyl-6-nitrobenzoic Anhydride”. Chem. Asian J. 3 (2): 454. doi:10.1002/asia.200700305.
関連項目
[編集]外部リンク
[編集]- Shiina, I.; Hashizume, M.; Yamai, Y.; Oshiumi, H.; Shimazaki, T.; Takasuna, Y.; Ibuka, R. (2005). “Enantioselective Total Synthesis of Octalactin A Using Asymmetric Aldol Reactions and a Rapid Lactonization To Form a Medium-Sized Ring”. Chem. Eur. J. 11 (22): 6601. doi:10.1002/chem.200500417.
- Schweitzer, D.; Kane, J. J.; Strand, D.; McHenry, P.; Tenniswood, M.; Helquist, P. (2007). “Total Synthesis of Iejimalide B. An Application of the Shiina Macrolactonization”. Org. Lett. 9 (22): 4619-4622. doi:10.1021/ol702129w.
- M. W. Chojnacka, R. A. Batey (2018). “Total Synthesis of (+)-Prunustatin A: Utility of Organotrifluoroborate-Mediated Prenylation and Shiina MNBA Esterification and Macrolactonization To Avoid a Competing Thorpe–Ingold Effect Accelerated Transesterification”. Org. Lett. 20: 5671. doi:10.1021/acs.orglett.8b02396.
- Xu, S.; Held, I.; Kempf, B.; Mayr, H.; Steglich, W.; Zipse, H. (2005). “The DMAP-Catalyzed Acetylation of Alcohols—A Mechanistic Study (DMAP = 4-(Dimethylamino)pyridine)”. Chem. Eur. J. 11 (16): 4751-4757. doi:10.1002/chem.200500398.
