染色体不分離
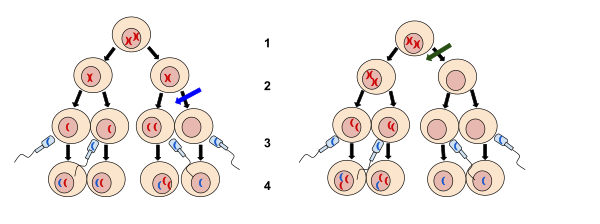
染色体不分離(せんしょくたいふぶんり、英: nondisjunction)とは、細胞分裂(有糸分裂/減数分裂)時に相同染色体または姉妹染色分体が適切に分離しない現象である。不分離には、減数第一分裂において相同染色体対が分離しない場合、減数第二分裂において姉妹染色分体が分離しない場合、有糸分裂において姉妹染色分体が分離しない場合の3つのケースがある[1][2][3]。不分離の結果、異常な染色体数(異数性)を持つ娘細胞が生じる。
カルヴィン・ブリッジスとトーマス・ハント・モーガンは、コロンビア大学の動物学研究室で働いていた1910年の春に、キイロショウジョウバエDrosophila melanogasterの性染色体の不分離を発見した[4]。
種類
[編集]一般的に、染色体の規則正しい分配を伴うあらゆる種類の細胞分裂過程で染色体不分離が生じる場合がある。高等動物では、こうした細胞分裂には3つの種類がある。減数第一分裂と第二分裂は有性生殖のために配偶子(卵と精子)を形成する際に行われる特殊な細胞分裂形態であり、有糸分裂はそれ以外の全ての細胞が利用する細胞分裂の形態である。
減数第二分裂
[編集]排卵された卵は、受精によって第二分裂が開始されるまで、第二分裂中期で停止している[5]。第二分裂後期には、有糸分裂の分離過程と同様に、第一分裂で二価染色体の分離によって生じた姉妹染色分体の対がさらに分離される。卵母細胞では、姉妹染色分体の一方は第二極体へ分離され、もう一方が卵にとどまる。精子形成過程においては減数分裂は対称的であり、第一分裂後には各一次精母細胞から2つの二次精母細胞が生じ、最終的に第二分裂後には4つの精子が形成される。第二分裂での不分離は染色体異数性症候群の原因となる可能性があるが、第一分裂における不分離よりはかなり小規模である[6]。

有糸分裂
[編集]有糸分裂による体細胞の分裂は、S期の遺伝物質の複製に続いて行われる。そのため、各染色体はセントロメアで連結された2つの姉妹染色分体から構成される。有糸分裂の後期には姉妹染色分体は分離し、細胞が分裂する前に各紡錘体極に向かって移動する。有糸分裂時の不分離の結果、娘細胞の一方は姉妹染色分体の双方を受け取るこことなり、もう一方は1本も受け取らないこととなる[2][3]。有糸分裂時の不分離は、不分離が起こった細胞に由来する娘細胞だけが染色体数の異常を示すため、体細胞モザイクの原因となり[3]、また網膜芽細胞腫などいくつかの種類のがんの発生に寄与する場合がある[7]。有糸分裂時の不分離は、II型トポイソメラーゼ、コンデンシンやセパラーゼの不活性化が原因となっている場合がある[8]。後期には、コヒーシンがセパラーゼによって切断される[9]。II型トポイソメラーゼとコンデンシンは絡み合った染色体の連結の除去を担う[10]。
分子機構
[編集]紡錘体チェックポイントの中心的役割
[編集]紡錘体チェックポイント(SAC)は、真核生物細胞において適切な染色体分離を司る分子的安全装置である[11]。SACは全ての相同染色体(二価染色体または四分染色体)が紡錘体に整列するまで、後期への進行を阻害する。整列が完了してはじめて、SACは後期促進複合体(APC)の阻害を解除し、APCが後期への不可逆的な進行を開始させる。
減数分裂における性特異的差異
[編集]ヒトの染色体異数性症候群の症例研究からは、こうした疾患の大部分が母親に由来することが示されている[5]。このことからは、なぜ女性の減数分裂はよりエラーが起こりやすいのか、という疑問が生じる。女性の卵形成と男性の精子形成の最も顕著な差異は、卵母細胞は最大で数十年もの長い間、減数第一分裂前期の終盤で停止しているという点である。一方、男性の配偶子は減数第一分裂と第二分裂の全ての段階を迅速に通過する。男性と女性の減数分裂でみられる他の重要な差異は、相同染色体間の組換え頻度である。男性では、ほぼすべての染色体対が少なくとも1か所の乗換えによって連結されているが、ヒトの卵母細胞の10%以上では、乗換えが起こっていない二価染色体が少なくとも1つ存在する。組換えの失敗や不適切な位置での乗換えがヒトの染色体不分離に寄与することは詳細に記載されている[5]。
加齢に伴うcohesin tieの喪失
[編集]ヒトの卵母細胞では長期にわたって減数分裂が停止しているため、コヒーシンによる染色体間のつなぎ合わせ(cohesin tie)の減少やSAC活性の低下が加齢と関連した分離制御のエラーに寄与している可能性がある[6][12]。コヒーシン複合体は姉妹染色分体を共に保持するとともに、紡錘体への接着部位ともなっている。コヒーシンは胚発生時に卵原細胞で新たに複製された染色体にロードされる。成熟した卵母細胞におけるS期完了後のコヒーシンの再ローディング能力は限定的である。そのため、減数第一分裂が完了するまでの長期間の停止は、コヒーシンのかなりの経時的喪失を引き起こす。コヒーシンの喪失は、減数分裂時の不適切な微小管-キネトコア間接着と染色体分離のエラーに寄与すると考えられている[6]。
影響
[編集]染色体不分離の結果、染色体数が不均衡な細胞が生じる。こうした細胞は異数体と呼ばれる。1本の染色体を喪失し(2n-1)、1つの染色体対の一方が欠けた欠陥を有する娘細胞はモノソミーと呼ばれる。1本の染色体を獲得し(2n+1)、通常の染色体対に加えて1本の染色体を持つ欠陥を有する娘細胞はトリソミーと呼ばれる[3]。異数体配偶子の受精が起こった場合には、いくつかの症候群が引き起こされる可能性がある。
モノソミー
[編集]ヒトで唯一生存可能なモノソミーはターナー症候群であり、X染色体モノソミーである。通常、他のモノソミーは初期胚発生時に致死となり、モザイクのように体の全ての細胞が影響を受けているわけではない場合か、モノソミーとなっている染色体の重複によって正常な染色体数が回復された場合("chromosome rescue")にのみ、生存が可能である[2]。
ターナー症候群(Xモノソミー; 45,X0)
[編集]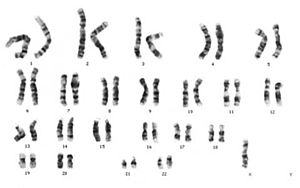
1本のX染色体の完全な喪失はターナー症候群の症例の約半数を占める。胚発生時に双方の染色体が存在することの重要性は、X染色体を1本しか持たない胎児の圧倒的大多数(>99%)が自然流産となることからも明らかである[13]。
常染色体トリソミー
[編集]常染色体トリソミーは、性染色体(X、Y)以外の染色体が正常な2コピーではなく3コピー存在することを意味する。
ダウン症候群(21トリソミー)
[編集]
ダウン症候群は21番染色体のトリソミーであり、ヒトの染色体数異常として最も一般的である[2]。症例の大部分は母親の減数第一分裂時の染色体不分離を原因とする[13]。トリソミーは新生児の少なくとも0.3%に生じ、25%近くが自然流産となる。胎児の喪失の最大の要因であり、既知の精神遅滞の要因として最も一般的である[14]。高齢出産はダウン症候群の原因となる減数分裂時の染色体不分離のリスクの高さと関係している。このことは、ヒトの卵母細胞の減数分裂の停止期間の長さ(40年以上に及びうる)と関係している可能性がある[12]。
エドワーズ症候群(18トリソミー)とパトウ症候群(13トリソミー)
[編集]ダウン症候群(21トリソミー)以外で出生可能なヒトのトリソミーは、エドワーズ症候群(18トリソミー)とパトウ症候群(13トリソミー)である[1][2]。他の染色体の完全なトリソミーは通常は生存不可能であり、流産の比較的高い要因となっている。トリソミー細胞系統に加えて正常細胞系統が存在する稀なモザイクの症例でのみ、他の染色体のトリソミーの発生の可能性がある[2]。
性染色体数的異常
[編集]性染色体数的異常(性染色体異数性)は、性染色体がXX(女性)またはXY(男性)以外の異常な数となっている疾患である。Xモノソミー(ターナー症候群)も性染色体数的異常に分類される場合もある。
クラインフェルター症候群(47,XXY)
[編集]クラインフェルター症候群はヒトで最も一般的な性染色体数的異常である。この症候群は男性の性腺機能不全や不妊の最も高頻度の要因である。大部分の症例は父親の減数第一分裂時の不分離によって引き起こされる[2]。この症候群の約80%では、余分なX染色体が1本存在し、XXYの核型となっている。残りの症例は、さらに多くの性染色体を持つ(48,XXXY; 48,XXYY; 49,XXXXY)か、モザイク(46,XY/47,XXY)や染色体の構造的異常である[2]。
XYY症候群(47,XYY)
[編集]XYY症候群の発生率は男性の800–1000出生につき1人程度である。外観や生殖能力は正常であり、重篤な症状はないため、未診断症例が多く存在する。通常、余分なY染色体は父親の減数第二分裂時の不分離によるものである[2]。
トリプルX症候群(47,XXX)
[編集]トリプルX症候群は、女性がX染色体を3本持つ性染色体数的異常である。患者の大部分では、軽度の神経心理学的・身体的症状がみられるだけである。余分なX染色体の起源は、症例の58–63%が母親の第一減数分裂、16–18%が母親の減数第二分裂、残りは受精後の有糸分裂時の不分離である[15]。
片親性ダイソミー
[編集]片親性ダイソミーは、染色体対の双方が同じ親から遺伝し、そのため同一である状態である。この現象は、不分離によるトリソミーとして開始した妊娠の結果である可能性が最も高い。ほとんどのトリソミーは致死的であるため、3本の染色体のうちの1本を失ってダイソミーとなった胎児のみが生存する。一例として、15番染色体の片親性ダイソミーはプラダー・ウィリ症候群やアンジェルマン症候群の一部の症例でみられる[13]。
モザイク症候群
[編集]モザイク症候群は初期胚発生時の有糸分裂の不分離によって引き起こされる場合がある。その結果、個体は倍数性(染色体数)が異なる細胞系統が混合した状態で成長する。モザイクは一部の組織のみに存在し、他の組織には存在しない可能性があり、またその影響はパッチ状や非対称的に出現する可能性がある。モザイク症候群の例としては、パリスター・キリアン症候群や伊藤白斑がある[13]。
悪性形質転換におけるモザイク性
[編集]
がんの発生には、細胞のゲノムの複数の変化を伴うことが多い(クヌードソン仮説)。ヒトの網膜芽細胞腫は、有糸分裂時の染色体不分離が悪性形質添加に寄与する、よく研究された例の1つである。13番染色体に位置し、Rbタンパク質をコードするするRB1遺伝子の変異は、網膜芽細胞腫の多くの症例で細胞遺伝学的解析によって検出される。13番染色体の一方のコピーのRB1遺伝子座の変異は、有糸分裂時の染色体不分離による他方の野生型13番染色体の喪失を伴っていることがある。こうした損傷の組み合わせのため、細胞は機能的ながん抑制タンパク質の発現を完全に喪失する[7]。
診断
[編集]着床前診断
[編集]着床前診断は遺伝子的に正常な胚を特定する技術であり、遺伝疾患の家族歴を有するカップルにとって有用である。体外受精によって子をもうけようとする人々にとってオプションとなる。着床前診断は時間がかかること、そして成功率は通常の体外受精と同程度であることが難点であると考えられている[16]。
核型分析
[編集]核型分析では、出生前の胎児の中期の細胞の研究のために羊水検査が行われる。異数性が問題となるかどうかを視覚的に明らかにするために光学顕微鏡が用いられる[17]。
極体診断
[編集]極体診断[18]は母親由来の染色体異数性や卵母細胞の染色体転座を検出するために用いられる。着床前診断と比較した利点は、短時間で行えることである。透明帯開孔法(zona drilling)またはレーザー穿孔(laser drilling)によって行われる[19]。
割球生検
[編集]割球生検は、透明帯から割球を取り出す技術である。異数性の検出に一般的に利用される[20]。手技の完了後には遺伝的解析が行われる。手技と関係したリスクのアセスメントにはさらなる研究が必要である[21]。
生活様式や環境の影響
[編集]生活様式や環境、職業上の危険への精子の曝露は、異数性のリスクを高める可能性がある。タバコの喫煙は異数性誘発因子であることが知られている。喫煙は異数性の1.5倍から3.0倍の増加と関係している[22][23]。他の研究では、アルコール消費[24]、ベンゼンへの職業性曝露[25]、フェンバレレート[26]やカルバリル[27]といった殺虫剤への曝露も異数性のリスクを高めることが示唆されている。
出典
[編集]- ^ a b Simmons, D. Peter Snustad, Michael J. (2006). Principles of genetics (4th ed.). New York, NY [u.a.]: Wiley. ISBN 9780471699392
- ^ a b c d e f g h i Bacino, C.A.; Lee, B. (2011). “Chapter 76: Cytogenetics”. In Kliegman, R.M.; Stanton, B.F.; St. Geme, J.W. et al.. Nelson Textbook of Pediatrics, 19th Edition (19th ed.). Philadelphia: Saunders. pp. 394–413. ISBN 9781437707557
- ^ a b c d Strachan, Tom; Read, Andrew (2011). Human molecular genetics (4th ed.). New York: Garland Science. ISBN 9780815341499
- ^ Thomas Hunt Morgan (August 31, 2012). Sex-Linked Inheritance in Drosophila. Ulan Press. pp. 10–11
- ^ a b c Nagaoka, SI; Hassold, TJ; Hunt, PA (Jun 18, 2012). “Human aneuploidy: mechanisms and new insights into an age-old problem.”. Nature Reviews Genetics 13 (7): 493–504. doi:10.1038/nrg3245. PMC 3551553. PMID 22705668.
- ^ a b c Jones, K. T.; Lane, S. I. R. (27 August 2013). “Molecular causes of aneuploidy in mammalian eggs”. Development 140 (18): 3719–3730. doi:10.1242/dev.090589. PMID 23981655.
- ^ a b eds, Charles R. Scriver ... [] (2005). The online metabolic & molecular bases of inherited disease (8th ed.). New York: McGraw-Hill. ISBN 9780079130358
- ^ Quevedo, O; García-Luis, J; Matos-Perdomo, E; Aragón, L; Machín, F (2012). “Nondisjunction of a single chromosome leads to breakage and activation of DNA damage checkpoint in G2.”. PLOS Genetics 8 (2): e1002509. doi:10.1371/journal.pgen.1002509. PMC 3280967. PMID 22363215.
- ^ Banks, P (Feb 1977). “Pulp changes after anterior mandibular subapical osteotomy in a primate model.”. Journal of Maxillofacial Surgery 5 (1): 39–48. doi:10.1016/s0301-0503(77)80074-x. PMID 403247.
- ^ Holm, C; Goto, T; Wang, JC; Botstein, D (Jun 1985). “DNA topoisomerase II is required at the time of mitosis in yeast.”. Cell 41 (2): 553–63. doi:10.1016/s0092-8674(85)80028-3. PMID 2985283.
- ^ Sun, S.-C.; Kim, N.-H. (14 November 2011). “Spindle assembly checkpoint and its regulators in meiosis”. Human Reproduction Update 18 (1): 60–72. doi:10.1093/humupd/dmr044. PMID 22086113.
- ^ a b Eichenlaub-Ritter, Ursula (2012). “Oocyte ageing and its cellular basis”. The International Journal of Developmental Biology 56 (10–11–12): 841–852. doi:10.1387/ijdb.120141ue. PMID 23417406.
- ^ a b c d Gleason, H. William; Taeusch, Roberta A.; Ballard, Christine A., eds (2005). Avery's diseases of the newborn (8th ed.). Philadelphia, Pa.: W.B. Saunders. ISBN 978-0721693477
- ^ Koehler, KE; Hawley, RS; Sherman, S; Hassold, T (1996). “Recombination and nondisjunction in humans and flies.”. Human Molecular Genetics 5 Spec No: 1495–504. doi:10.1093/hmg/5.Supplement_1.1495. PMID 8875256.
- ^ Tartaglia, NR; Howell, S; Sutherland, A; Wilson, R; Wilson, L (May 11, 2010). “A review of trisomy X (47,XXX).”. Orphanet Journal of Rare Diseases 5: 8. doi:10.1186/1750-1172-5-8. PMC 2883963. PMID 20459843.
- ^ Harper, JC; Harton G (2010). “The use of arrays in preimplantation genetic diagnosis and screening”. Fertil Steril 94 (4): 1173–1177. doi:10.1016/j.fertnstert.2010.04.064. PMID 20579641.
- ^ “Karyotyping”. National Institute of Health. 7 May 2014閲覧。
- ^ van der Ven, Katrin; Montag, Markus; van der Ven, Hans (2008-03). “Polar body diagnosis - a step in the right direction?”. Deutsches Arzteblatt International 105 (11): 190–196. doi:10.3238/arztebl.2008.0190. ISSN 1866-0452. PMC 2696746. PMID 19629197.
- ^ Montag, M; van der Ven, K; Rösing, B; van der Ven, H (2009). “Polar body biopsy: a viable alternative to preimplantation genetic diagnosis and screening”. Reproductive Biomedicine Online 18 Suppl 1: 6–11. doi:10.1016/s1472-6483(10)60109-5. PMID 19281658.
- ^ Parnes, YM (Mar–Apr 1989). “RCT controversy.”. Journal of Obstetric, Gynecologic, & Neonatal Nursing 18 (2): 90. doi:10.1111/j.1552-6909.1989.tb00470.x. PMID 2709181.
- ^ Yu, Y; Zhao, Y; Li, R; Li, L; Zhao, H; Li, M; Sha, J; Zhou, Q et al. (Dec 6, 2013). “Assessment of the risk of blastomere biopsy during preimplantation genetic diagnosis in a mouse model: reducing female ovary function with an increase in age by proteomics method.”. Journal of Proteome Research 12 (12): 5475–86. doi:10.1021/pr400366j. PMID 24156634.
- ^ “Cigarette smoking and aneuploidy in human sperm”. Mol. Reprod. Dev. 59 (4): 417–21. (2001). doi:10.1002/mrd.1048. PMID 11468778.
- ^ “Smoking cigarettes is associated with increased sperm disomy in teenage men”. Fertil. Steril. 70 (4): 715–23. (1998). doi:10.1016/S0015-0282(98)00261-1. PMID 9797104.
- ^ “Chronic alcohol exposure induces genome damage measured using the cytokinesis-block micronucleus cytome assay and aneuploidy in human B lymphoblastoid cell lines”. Mutagenesis 26 (3): 421–9. (2011). doi:10.1093/mutage/geq110. PMID 21273273.
- ^ “Application of toxicogenomic profiling to evaluate effects of benzene and formaldehyde: from yeast to human”. Ann. N. Y. Acad. Sci. 1310 (1): 74–83. (2014). Bibcode: 2014NYASA1310...74M. doi:10.1111/nyas.12382. PMC 3978411. PMID 24571325.
- ^ “Genotoxic effects on human spermatozoa among pesticide factory workers exposed to fenvalerate”. Toxicology 203 (1–3): 49–60. (2004). doi:10.1016/j.tox.2004.05.018. PMID 15363581.
- ^ “Genotoxic effects on spermatozoa of carbaryl-exposed workers”. Toxicol. Sci. 85 (1): 615–23. (2005). doi:10.1093/toxsci/kfi066. PMID 15615886.
