オセルタミビル
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | タミフル |
| 胎児危険度分類 | |
| 法的規制 | |
| 薬物動態データ | |
| 生物学的利用能 | 75% |
| 代謝 | 肝臓 |
| 半減期 | 6–10 時間 |
| 排泄 | 尿中 |
| 識別 | |
| CAS番号 |
196618-13-0 |
| ATCコード | J05AH02 (WHO) |
| PubChem | CID: 65028 |
| DrugBank |
DB00198 |
| ChemSpider |
58540 |
| UNII |
20O93L6F9H |
| KEGG |
D08306 |
| ChEBI |
CHEBI:7798 |
| ChEMBL |
CHEMBL1229 |
| 化学的データ | |
| 化学式 | C16H28N2O4 |
| 分子量 | 312.4 g/mol |
| |
オセルタミビル(oseltamivir)は、インフルエンザウイルスに効く抗ウイルス薬である。オセルタミビルリン酸塩として、スイスのロシュ社により商品名「タミフル」(tamiflu、登録商標第4376708号ほか)で販売されている。日本ではロシュグループ傘下の中外製薬が製造輸入販売元である。また、後発医薬品として、沢井製薬が商品名「オセルタミビル サワイ」で発売している。
A型、B型のインフルエンザウイルスに作用する(B型には効きにくい傾向がある)。C型インフルエンザには効果がない。鳥インフルエンザを引き起こすのは、A型インフルエンザウイルスであり、H5N1型の高病原性トリインフルエンザウイルスにも、ある程度有効との研究結果が報告されている[1]。
オセルタミビルは、トウシキミ(八角)から採取されるシキミ酸から、10回の化学反応を経て合成されていた[2]。
2014年には、コクラン共同計画による完全な治験データの再分析結果が公開され、当初の服用の理由である入院や合併症を減少させるという十分な証拠はなく、成人では発症時間を7日から6.3日へと減少させる程度であり、副作用も含めて、使用指針の見直しが必要であると報告された[3]。
国際連合の世界保健機関は、以前は不完全な解析しか利用できず[4]、2009年に世界保健機関の必須医薬品の一覧に追加されたが、2017年に「補足的な薬」に格下げされ、今後は医薬品リストからの除去もありうる[5]。世界保健機関は、重篤な入院患者でインフルエンザウイルスの感染が疑われる場合のみ、使用を制限することを推奨した[6]。
作用機序
[編集]オセルタミビルは,ウイルスが宿主細胞から別の細胞へと感染を広げる際に必要となるノイラミニダーゼ (neuraminidase, NA) という酵素(糖タンパク質)を阻害することでインフルエンザウイルスの増殖を抑制する。 感染し細胞内で増殖したウイルス粒子は、細胞から放出される際にノイラミニダーゼによって遊離し感染を広げるが[7]、ノイラミニダーゼ阻害薬によってウイルス粒子の遊離ができず新たな感染が抑えられる。 これがノイラミニダーゼ阻害薬の作用機序である[8]。
ザナミビル(商品名リレンザ)も標的阻害酵素は同じNAであり、ともにNAの基質であるシアル酸の類似体である。ただし、吸入薬として用いるザナミビルに対し、オセルタミビルでは活性体のカルボキシ側鎖をエチルエステル化して脂溶性を高めることにより、内服用にプロドラッグ化されている。
また、気分、認知、行動に深く関わる様々な神経伝達物質受容体やイオンチャネル、代謝酵素、トランスポーター等に対する結合活性や阻害活性について調べた報告では、NMDA受容体に対しては、未変化体のオセルタミビルは3µM濃度で14%阻害、30µM濃度で23%阻害、活性代謝物オセルタミビルカルボン酸は3µM濃度で21%阻害であったことから、異常行動等の精神神経系副作用との関連性が示唆されている[9][10][11]。
剤形
[編集]本薬の投与法は経口投与であるため感染部位への到達時間は遅いが、ザナミビルの吸入投与よりも投与法が一般的に容易であるため、高齢者・小児にも投与しやすい。2001年2月、タミフルカプセル75が、2002年4月、タミフルドライシロップ3%(散剤)がそれぞれ薬価収載され、中外製薬が製造販売している。
また、2018年9月(薬価収載は同年6月)には後発医薬品として、沢井製薬がオセルタミビルカプセル75mg「サワイ」、オセルタミビルDS3%「サワイ」をそれぞれ発売している。なお世界においては、30mg(DS3%相当)、45mgが存在する。
有効性
[編集]インフルエンザ予防薬としても使用することができる(ドライシロップは除く)。ただし、予防薬としての処方は、日本では診療報酬の適用外で自由診療になる。また英国国立医療技術評価機構(NICE)の2008年の診療ガイドラインは、予防でのオセルタミビルの使用は特定のリスク群を除いて推奨していない[12]。
A型、B型インフルエンザウイルス(非耐性)に感染し、発症後48時間以内に投与すれば、有意に罹患期間を短縮できる。発症後、48時間以降に投与を開始した場合の有効性は確立していない[13]。これは、オセルタミビルはウイルスが新たに拡散するのを阻害する薬剤であって、既に増殖したウイルスを失活させる効果がないからである。
一般的臨床成績としては、海外臨床試験において、発症2日以内の投与によって、発熱期間を24時間、罹病期間を26時間短縮した。服用しない場合、発熱は通常3–7日間続く。頻度の高い副作用は、腹痛・下痢・嘔気が報告されている。
ロシュが、入院や合併症リスクを低下させると主張し、各国政府が数十億米ドルを投じてオセルタミビルを備蓄した後[14]、2012年、コクラン共同計画が日本、アメリカ、欧州の規制機関に提出された臨床試験のデータをシステマティック・レビューし、21時間発症時間が短縮されることと、感染や入院のリスクを低下させるかは結論できないとした[15]。ロシュ社に完全な臨床試験のデータの公開が要求されており[16]、2014年4月10日にその分析結果が公開された[17]。伴って、医学誌BMJとコクランは、未公開の臨床試験データの検証により服用による効果は限定的であり、世界の政府機関は証拠が改定されたことによる見直しが必要との声明を出した[18][3]。
完全なデータの分析によれば、最も厳密な医療統計的手法である無作為化2重盲検法を採用した臨床試験データのみに絞り、タミフルの有効性を再検討したところ、当初の理由である入院や合併症を減少させるという十分な証拠はなく、成人では発症時間を7日から6.3日へと減少させ、小児では効果は不明であり、5%に嘔吐・悪心の副作用が生じ、精神医学的な副作用を1%増加させるとの結果が得られたとしている[3]。
一方、同時期に発表された38カ国、29,234人の患者を対象にした78件の研究に対する別のシステマティック・レビューでは、2009年新型インフルエンザの世界的流行の際、ノイラミニダーゼ阻害薬がインフルエンザによる死亡率を25%低下させたとし、その有益性を評価する報告もなされている[19]。しかし、これは完全なデータではなく、データ提供依頼した際の19%のデータに限られており、影響はないというが研究にロシュ社が出資しており、またランダム化比較試験以外が含まれているとの指摘を受けた[20]。この系統レビューを引用しながら、ネイチャー誌に掲載された記事は、症状の減少期間が少ないということが、一般誌に役に立たないと誤解されるように記述されていることや、コクラン共同計画およびBMJ誌の分析結果は、健康な被験者に合併症がほとんど起こらないことを明かしたのにすぎないとした[21]。
オセルタミビルは2009年に、世界保健機関の必須医薬品の一覧に追加されたが、2017年に「補足的な薬」に格下げされた。以前には製薬会社が出資した研究のプール解析と、不完全なシステマティックレビューという証拠が利用できたが、新たに完全なシステマティックレビューが証拠として利用できるようになった[4]。季節性インフルエンザとパンデミックなインフルエンザに対する効果に対する新たな証拠があり、以前より効果が少ないと推定されるため、重篤な入院患者でインフルエンザウイルスの感染が疑われる場合のみの使用に制限することを推奨し、また使用を支持するようなさらなる証拠がなければ医薬品一覧からの除去がありえるとした[6]。
重要な基本的注意
[編集]日本において、2019年3月1日付け厚生労働省医薬・生活衛生局医薬安全対策課長名通知で、「重要な基本的注意」の項に 「出血があらわれることがあるので、患者及びその家族に対して、血便、吐血、不正子宮出血等の出血症状があらわれた場合には医師に連絡するよう説明すること。」 を追記し、「相互作用」の項を新たに設け、「併用注意」として「ワルファリン」が追記された[22]。
経緯
[編集]1996年に抗ウイルス薬を数多く手掛ける、アメリカ合衆国のギリアド・サイエンシズ(1997年から2001年まで元アメリカ合衆国国防長官のドナルド・ラムズフェルドが会長を務めた[23])が開発、スイスのロシュがライセンス供与を受け全世界での製造、販売を行っている[24][25]。中国においては Shanghai Pharmaceutical Group 社[26]、インドにおいては Hetero Drugs 社[27]が製造のサブライセンスを保持し、製造している。
1999年にアメリカ食品医薬品局(FDA)が承認し、まもなく欧州医薬品庁 (EMA) も承認し、大半がロシュが出資した研究によって、安全性や有効性が宣伝された[28]。
日本では2001年2月に保険適用となり、以降広く使用されている。しかし、オセルタミビルに耐性を持つインフルエンザウイルスも、2004年頭頃[要出典]から徐々に見られるようになり[29]、2009年1月の調査では、日本のH1N1亜型への感染者のうち90%以上から、薬剤耐性を持つインフルエンザウイルスが検出されている[30]。
また、幼児・小児など免疫力が弱い者にオセルタミビルを投与し続けた場合、インフルエンザウイルスの淘汰に時間がかかるため、その間に体内のウイルスがオセルタミビルに対して耐性を持つとされている。そのため小児への投与は慎重に行う必要がある。
2005年11月に FDA の小児諮問委員会で報告された際には、「タミフル」の全世界での使用量のうち、およそ75%を日本での使用が占めており、世界で最も多く使用されている上、同2位のアメリカ合衆国と比べ、子供への使用量は約13倍であった2005年には、新型インフルエンザの発生懸念のため、一部の大病院などで買い占めがおこり、世界的に品薄状態と報じられた。
また、原料であるシキミ酸を含む八角(トウシキミの果実)の買占めが懸念された。2006年に入ると、八角のような天然物質ではなく、石油由来の、より入手容易な化学物質を原料とした、リン酸オセルタミビルの化学合成法が、日本とアメリカ合衆国の2つの研究グループによって発表された。その後も原材料の安定供給を目指し、複数のグループにより研究が行われている。
2009年までには、インフルエンザのパンデミックへの恐れが絶頂期となり、堅牢な科学的証拠のないまま、世界保健機関から勧告がなされ、各国はタミフルを大量に備蓄することへとつながった[28]。2009年に世界保健機関が実施したシステマティックレビューでは、死亡率や入院を減少させる可能性があるとしたが、集まった証拠の質は低かったため、一般化できるものではなく複数のバイアスがあった[28]。
2009年には、ロシュが未公表の試験に基づいて、オセルタミビルが入院と合併症のリスクを低下させると主張し、新型インフルエンザのパンデミックに備えて、アメリカ合衆国連邦政府は15億米ドル、欧州の政府は10億ユーロを費やし備蓄した[14]。
『イギリス医師会雑誌』(BMJ)は、ロシュに対して完全な臨床試験データを公開するよう促していた[16]。
#有効性に示したように、完全なデータ公開によって、ロシュの見解は訂正されることとなったが、このような事例の再発を防ぐには、医薬品規制庁と製薬会社は、データをパブリックドメインに置き、情報共有する必要がある[28]。
薬剤耐性
[編集]他の抗ウイルス剤と同様に、オセルタミビルも乱用による薬剤耐性ウイルスの出現が予想された。2004年の7月までの臨床試験の報告では、大人0.33%、子供4.0%、合計1.26%に薬剤耐性ウイルスが確認された。この薬剤抵抗性は、ノイラミニダーゼの1つのアミノ酸残基の変異が原因である[31]。
2004年
[編集]オセルタミビルに対して薬剤耐性を持ったH3N2の変異株が、「タミフル」によって治療を受けた日本の子供たち50グループ中から18%の割合で検出されたことが報告された[32]。これは、日本の子供たちから薬剤耐性をもったH1N1の変異株が16.3%の割合で見つかったという別の報告と類似している[31]。
この論文の著者は、予想より高い抵抗性に対しいくつかの説を提唱した。
- 子供の感染期間は大人より長いため、ウイルスが薬剤耐性を獲得する十分な時間があった可能性がある。
- 技術の発達により検出率が向上した可能性がある[32]。
- 日本の医療制度が他国のものと異なっており、タミフルの投与量が最適量以下だった可能性がある。
さらに、「タミフル」によって治療を受けていたベトナムの少女1人から、高い薬剤耐性を示すH5N1が検出された[33][34]。
2005年
[編集]de Jong らは H5N1 に感染した2人のベトナム人のウイルスの耐性の変化を研究し、他の6件と比較した。その結果、症状の悪化に比例して薬剤耐性が上がる可能性があることがわかった。さらに、オセルタミビルを最適量投与されてもウイルスの増殖を完全に抑えることは出来ず、耐性ウイルスが出現した可能性があることも報告した。また、個人がタミフルを備蓄することにより、タミフルの不足と H5N1 耐性株の出現が起こったのではないかと予想された[35]。
薬剤耐性はパンデミックが起こるための重要な要素である。トリインフルエンザは持続期間が長いため、より耐性を獲得しやすくなっている可能性がある。このような耐性ウイルスが大流行を起こすことが危険視されている[32]。
ノイラミニダーゼをコードしている遺伝子領域は非常に少ないため、ノイラミニダーゼの変異のバリエーションはそんなに多くはない。そのため、オセルタミビル耐性株は酵素機能を阻害することによって抑制できるかもしれない。
ノイラミニダーゼの変化の割合は少ないため、オセルタミビルとザナミビルを使う上で2つの利点がある。
- これらの薬剤は色々な種類のインフルエンザウイルスに有効である。
- 強い耐性を持った変異株が出現する可能性が低い[31]。
オセルタミビルによって治療された子供たちから、オセルタミビル耐性株が発見された。しかし、この耐性株はヒトからヒト、もしくは鳥からヒトへ感染する株ではなかった[32]。
2005年1月のOkamotoらの研究[36]で、1歳未満の子供に投与した結果が報告された。
2007年
[編集]日本の研究者はこれらの薬剤を使わなかった患者から、ノイラミニダーゼ耐性B型インフルエンザウイルス (neuraminidase-resistant Influenza B virus strain) を1.7%の割合で発見した[37]。2008年、WHOはカナダのH1N1の81サンプルの内、8つがオセルタミビルに対し耐性を持っていたことを発表した[38]。しかし、2008年1月には「タミフル」使用量の少ないノルウェーから75%の割合でオセルタミビル耐性ウイルスの発見が報告されており、使用量と耐性ウイルスの出現の因果関係は明らかではない。
2009年
[編集]WHOは、2008年12月28日時点の集計として、Aソ連型オセルタミビル耐性ウイルス検出の報告を、日本 14検体中13検体、イギリス 14検体中13検体、ガーナ 1検体中1例、カナダ 1検体中1例、イスラエル 1検体中1例、ノルウェー 1検体中1例で、全世界では33検体中30検体から耐性ウイルスが検出されたとしている[39]。
日本臨床内科医会インフルエンザ研究班では、「2008/2009年シーズンの抗インフルエンザ薬治療指針(私案)」を策定し示した[40]。その要旨は、現時点では混在型で流行しており、オセルタミビル耐性H1N1の流行が否定的な場合は「タミフル」も使用可能とし、オセルタミビル耐性 H1N1 の流行が確認された場合は「リレンザ」が望ましいとしている。
2009年7月現在日本のA型インフルエンザの97%を占めている新型インフルエンザ(H1N1だが、ソ連型とは異なる)は、ほとんどオセルタミビルに対する耐性を持っておらず、依然として有効とされる。
2009年4月 - 8月の遺伝子配列バンクの集計では、日本から提出された新型インフルエンザ・ウイルス98例中、オセルタミビル耐性は4例だった。
2009年8月の田代による厚労省への報告によると、新型インフルエンザ耐性ウイルスの出現例はデンマーク、大阪、山口、徳島、岩手、香港、カナダである(極めて少ない)。
異常行動
[編集]2005年11月、オセルタミビルの副作用が疑われる事例として、日本で「タミフル」を服用していた2人の患者が、異常行動の結果、事故死(転落死など)したことが報道された。日本の医薬品の添付文書の警告枠には以下のように書かれている。合併症や既往歴などからハイリスクとされる10代以外には使用を差し控え、使用にあたっても異常行動が起きる場合があり、2日間1人にさせないということである。
2017年11月、厚生労働省は、抗インフルエンザウイルス薬の服用にかかわらず異常行動が報告されているため、未成年ではできる限り1階に寝かせ、それができない高層では窓を施錠し、ベランダのない部屋で寝かせるなどの注意喚起を行った[41]。
2014年4月、欧州医薬品庁(EMA)およびロシュ社から得たオセルタミビルに関する83件の臨床試験データのうち、分析対象としての基準を満たした20件の無作為化試験に対する系統的レビューが公開され、精神的な事象は服用により1%増加すると報告した(プラセボ投与群での副作用の頻度1.32%に対してオセルタミビル投与群では2.35%)[42]。また、この報告ではオセルタミビルの有効性が限定的であることも指摘しており、BMJ誌とコクラン共同計画は、併せて系統的レビューの結果が報告されたザナミビルとともに、ノイラミニダーゼ阻害薬投与について、危険性と有益性の兼ね合いから使用指針の見直しが必要であるとの声明を発表している[3]。
タミフルのみにおける低体温や異常行動につながる急性に生じる反応には、モノアミン酸化酵素阻害作用、GABA(中枢神経抑制)やニコチン性アセチルコリン受容体への作用への機序が、動物研究から想定される[10]。 また、ノイラミニターゼ阻害作用によってゆっくり生じる反応は、ウイルスを減少させずに症状を減少させており、抗体の産生を低下させ、また再感染に対する免疫の発生を減少させて再感染しやすくなる可能性があり、心臓に良くない影響が考えられるQT延長、様々な器官に及び、また最初の服用から数日後に服用した際の発症という遅い精神症状も報告されている[11]。
最初の異常行動の報告から2008年まで
[編集]2005年に日本で、突然死や異常行動が報告された。11月17日、アメリカ食品医薬品局 (FDA) は、インフルエンザ治療薬「タミフル」を服用した日本の小児患者12人が死亡したと公表した。4人が突然死、4人が心肺停止でそれぞれ死亡、意識障害・肺炎・窒息・急性膵炎により、4人が死亡。他国の死亡例はない。また、皮膚超過敏症が12件、幻覚、異常行動などの精神神経病的な症状が32件、世界で報告されたが、ほとんどが日本であった。FDAは、タミフルとの因果関係の特定は困難とし、小児科諮問委員会に報告書を提出した[43]。
厚生労働省は、日本の13人の死者を把握したとし、FDA は、タミフルがアメリカ合衆国で認可された、2004年3月から2005年4月までの安全性に関する調査を公表し、「タミフル」の副作用に関する監視を2年間継続する方針を明らかにした[44]。11月30日、日本小児科学会は、タミフルと異常行動との医学的因果関係を否定する見解を発表した[45]。
2007年2月28日、宮城県仙台市在住の中学生が、タミフル服用後にマンションから転落死する事故などの報告が続いたことから、厚生労働省は「インフルエンザ治療に携わる医療関係者の皆様へ[46]」という文書を発表し、「現段階でタミフルの安全性に重大な懸念があるとは考えておりません」としつつも、医療関係者に対し、万が一の事故を防止するための予防的な対応として、特に小児・未成年者については、インフルエンザと診断され治療が開始された後は、タミフルの処方の有無を問わず、異常行動発現のおそれがあることから、自宅において療養を行う場合、
- 異常行動の発現のおそれについて説明すること
- 少なくとも2日間、保護者等は小児・未成年者が1人にならないよう配慮すること
と患者や家族に説明するよう、注意を喚起することとなった。同省は、同年3月20日、「タミフル服用後の異常行動について(緊急安全性情報の発出の指示)[47]」を発表。
2007年3月22日、厚生労働省が十代の未成年患者の使用制限を緊急発表。「タミフルは2001年2月の日本発売以来、のべ約3500万人が使用した。昨年までに服用後の死亡が報告されたのは54人で、転落などの異常行動で、2007年2月28日までに死亡したのは5人。5人の死亡時の年齢は12–17歳」(一部意訳修正済み)。
2007年9月29日、セントルイス・ワシントン大学精神医学教授の和泉幸俊らは、オセルタミビルおよびその代謝産物を、若いラットより摘出した脳細胞に浸すと、神経細胞が一斉に興奮(発火)することを報告した。実際の組織内濃度をはるかに超えた状態で行われた実験のため、これが臨床的意味を持つものかどうかは未確定である。これらの成分が生体内において、血液脳関門を通過し実際に大脳に至るとは証明されていない(現時点では、血液脳関門を通過できないとみられている)[48]。
2007年12月25日、厚生労働省の薬事・食品衛生審議会安全対策調査会は、前年冬にインフルエンザと診断された17歳以下の患者約1万人を対象とした疫学調査の結果、異常行動の発生率は「タミフル」を服用しなかった患者(22%)に対して服用患者では10%で、10–17歳でも同様とした上で、生命にかかわる異常行動では発生率に大きな差が見られなかったことから「まだ解析の余地があり、タミフルと異常行動の因果関係は現時点で判定できない」として、10代への使用制限措置を「妥当」とする見解を発表[49]。
横浜労災病院の報告によれば、2006年12月から2007年3月までに、ウイルス抗原迅速検査で陽性となった1歳以上の335名の患者を対象とした調査結果では、初回内服から異常行動の発生までは 1.5時間から30時間と幅があり、オセルタミビルを内服した群では、異常行動の発生が有意に低かった、従ってオセルタミビルは異常行動を抑制している可能性が示唆される[50]としている。
2008年に東京大学の研究グループが、ラットの海馬をもちいた研究で、平時はばらついて興奮しているニューロンが、オセルタミビルを与えると回路全体が同期的に興奮する特異な発火現象と、これが本剤に限らず、他のノイラミニダーゼ阻害薬でも起こることや、実験動物では血液脳関門をオセルタミビルの薬効物質が移行することなど報告している[51][52]。
合成法
[編集]オセルタミビルとシキミ酸は全く構造が違う化合物であり、八角は単なる原材料に過ぎないため、インフルエンザウイルスに効果はない[53]。2009年にロシュは、シキミ酸を遺伝子組替えによる生合成で量産している[54]。
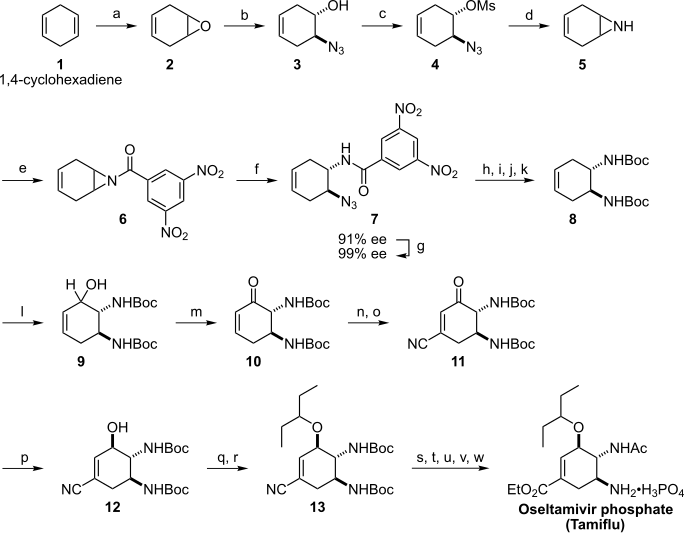
2006年時点では、オセルタミビルは天然物である (−)-シキミ酸を出発物質とした半合成によって作られていた。しかし、シキミ酸の供給量は限られたものであり、オセルタミビルをより大量に得るためには、入手容易な原料化合物を用いた全合成を行う必要があった[55]。
2006年、イライアス・コーリーによってブタジエンとアクリル酸を[56]、柴崎正勝によって 1,4-シクロヘキサジエンを出発物質とする[57]オセルタミビルの全合成法が報告された。
なお2007年には、柴崎グループから改良法が[58][59]、福山透らからも全く新しい合成ルートが発表されている[60]。さらに他のグループによりL-セリンを原料とする方法[61]、鉄カルボニル錯体を用いる方法[62]、D-キシロースを出発物質とする方法[63]も報告されている。
2009年には、東京理科大学・林雄二郎らのグループにより有機触媒及びカスケード反応を用いて3段階、収率57%のオセルタミビル全合成法が報告され[64]、2010年には林らのグループにより2工程、通算収率60%で合成できる改良法が報告された[65]。さらに、林らにより2013年に7回の反応による収率36%のワンポット合成法が報告された[66][67]。
ロシュ法
[編集]この節の加筆が望まれています。 |
コーリー法
[編集]この節の加筆が望まれています。 |

柴崎法
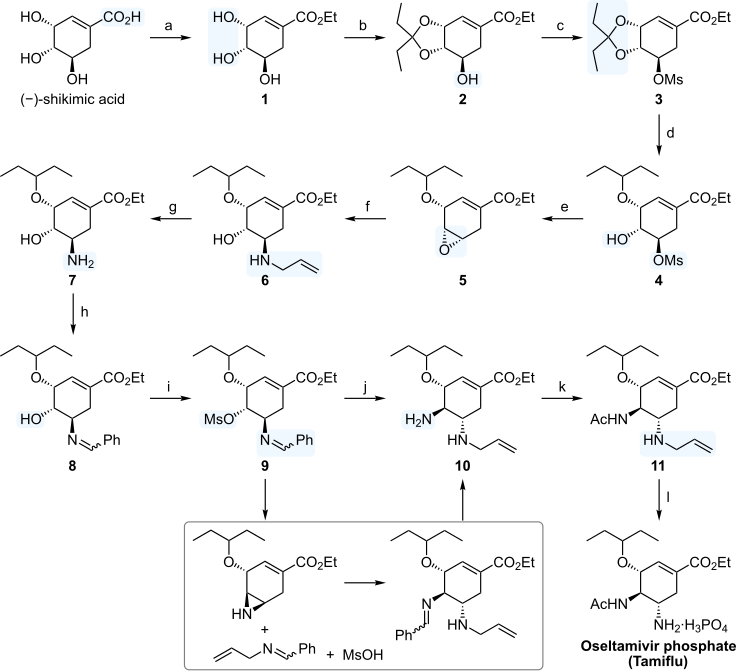
[編集]全合成を行う場合、分子内に3か所存在する不斉点をどのように導入するかが問題となる。柴崎法ではアジリジン 6 の不斉開環反応 (f) が鍵反応となっている。以下、合成経路を順に示す。
- まず、1,4-シクロヘキサジエン 1 を炭酸水素ナトリウムの存在下にメタクロロ過安息香酸でエポキシ化して 2 とし、アジ化ナトリウムで開環させラセミ体の 3 を得る。
- ヒドロキシ基をメシルクロリド/ピリジンでメシル化し、得られたアジド 4 を水素化アルミニウムリチウムでアミンへ還元して分子内環化を起こさせメソアジリジン 5 とする。
- 酸クロリド/トリエチルアミンで窒素上に3,5-ジニトロベンゾイル基を導入し6 とする。
- ここで 6 に対し、イットリウムトリイソプロポキシドとD-グルコース由来の不斉配位子から調整した不斉触媒とトリメチルシリルアジドを用い、アジド基を付加させる。
- 2 モル % の触媒存在下、プロピオニトリル中、室温にて48時間後に収率 96%、91% の鏡像体過剰率 (ee) で、2つの窒素原子がトランスに位置した 7 が得られる。
- 7 はイソプロピルアルコールから再結晶して光学純度を高め、99% ee とする。
- ジ-tert-ブチルジカルボネート/ジメチルアミノピリジンによるアミドの保護、加水分解による3,5-ジニトロベンゾイル基の除去、トリフェニルホスフィンを用いたアジドのアミンへの還元、そのアミノ基のtert-ブトキシカルボニル基 (Boc) での保護、の4段階を経てジアミドシクロヘキセン 8 を得る。
- 次に、残り2つの官能基のシクロヘキサン環上への導入を行う。まず二酸化セレンとデス・マーチン・ペルヨージナンで窒素原子の α 位を酸化する。
- アルコール 9 とエノン10の混合物(約3:2)が得られるが、これを単離することなくさらにデス・マーチン酸化を行いエノン 10 を単一生成物として得る。
- ここでさらに再結晶を行い光学的に純粋な(>99% ee)10を得る。
- これにビス(1,5-シクロオクタジエン)ニッケル(0)/1,5-シクロオクタジエン触媒でトリメチルシリルシアニドを 1,4 付加させたのち、N-ブロモスクシンイミド/トリエチルアミンで処理することで11 を得る。
- 得られた 11 に立体的に嵩高い水素化トリ(tert-ブトキシ)アルミニウムにより還元を行い立体選択的に(>20:1)12 を得る。
- 分子内光延反応で N-Boc アジリジンを生成させたのち、3-ペンタノール/三フッ化ホウ素・エーテル錯体で開環させ、ペンチルエーテルが導入された 13 とする。
- トリフルオロ酢酸でいったん両方の Boc 基を除去し、立体的に空いているアミノ基のみBoc基で再び保護し、もう一方のアミノ基には無水酢酸でアセチル化を施す。
- エタノール中塩酸で処理することでBoc基の除去と同時にシアノ基をエチルエステルへの変換を行う。
- 最後にリン酸で処理してリン酸塩とし、オセルタミビルを得る。
出典
[編集]- ^ A. Govorkova, Elena (2007年4月). “Efficacy of Oseltamivir Therapy in Ferrets Inoculated with Different Clades of H5N1 Influenza Virus”. p. 1414-1424. doi:10.1128/AAC.01312-06. 2009年4月30日閲覧。
- ^ “抗インフルエンザ薬「タミフル」の純化学的製造法”. 東京大学広報・情報公開記者発表一覧 (2006年3月1日). 2009年1月13日閲覧。
- ^ a b c d BMJ and Cochrane (10 April 2014). "Tamiflu & Relenza: how effective are they?" (Press release). Cochrane Collaboration. 2014年4月10日閲覧。、邦訳:BMJ誌(英国医師会雑誌)プレスリリース (PDF)
- ^ a b WHO必須医薬品専門委員会 (2017). The Selection and Use of Essential Medicines:2017 (pdf) (Report). p. 202-206. 2018年4月15日閲覧。
- ^ “WHO、タミフル格下げ 必須医薬品リスト”. 日本経済新聞. (2017年7月9日) 2018年3月10日閲覧。
- ^ a b WHO必須医薬品専門委員会 (2017). Executive Summary: The Selection and Use of Essential Medicines:2017 (pdf) (Report). 世界保健機関. p. 5. 2018年4月15日閲覧。
- ^ インフルエンザウイルス#ウイルス粒子の放出
- ^ 医薬品医療機器総合機構理事長. “薬機発第194 号審査結果通知書” (PDF). 医薬品医療機器情報提供ホームページ(厚生労働省). pp. 4. 2009年4月28日閲覧。
- ^ https://www.ncbi.nlm.nih.gov/pubmed/19917275
- ^ a b Hama, R.; Bennett, C. L. (2017). “The mechanisms of sudden-onset type adverse reactions to oseltamivir”. Acta Neurologica Scandinavica 135 (2): 148–160. doi:10.1111/ane.12629. PMC 5201449. PMID 27364959.
- ^ a b Hama, Rokuro (2016). “The mechanisms of delayed onset type adverse reactions to oseltamivir”. Infectious Diseases 48 (9): 651–660. doi:10.1080/23744235.2016.1189592. PMC 4973146. PMID 27251370.
- ^ 英国国立医療技術評価機構 (September 2008). Influenza (prophylaxis) - amantadine, oseltamivir and zanamivir (TA158) (Report). National Institute for Health and Clinical Excellence. pp. 1.3, 1.7. 2014年6月26日閲覧。
- ^ 中外製薬株式会社 (2004年7月3日). “効能・効果,用法・用量,使用上の注意(案) 及びその設定根拠” (PDF). p. 363. 2009年4月30日閲覧。
- ^ a b Peter C. Gøtzsche (14 December 2012). Corporate crime in the pharmaceutical industry is common, serious and repetitive (pdf) (Report). Nordic Cochrane Centre. 2014年6月4日閲覧。, これの短縮版は以下である:Gotzsche, P. C. (2012). “Big pharma often commits corporate crime, and this must be stopped”. BMJ 345 (dec14 3): e8462–e8462. doi:10.1136/bmj.e8462. PMID 23241451.
- ^ Jefferson, Tom; Jones, Mark A; Doshi, Peter; Del Mar, Chris B; Heneghan, Carl J; Hama, Rokuro; Thompson, Matthew J; Jefferson, Tom (2012). “Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children”. The Cochrane Database of Systematic Reviews: CD008965. doi:10.1002/14651858.CD008965.pub3. PMID 22258996.
- ^ a b Kmietowicz, Z. (2012). “Cochrane group rejects Roche's offer of "advisory board" to discuss analysis of oseltamivir data”. BMJ 345 (nov26 2): e8072–e8072. doi:10.1136/bmj.e8072. PMID 23183073.
- ^ Jefferson, Tom; Jones, Mark A; Doshi, Peter; Del Mar, Chris B; Hama, Rokuro; Thompson, Matthew J; Spencer, Elizabeth A; Onakpoya, Igho et al. (2014). “Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children”. The Cochrane Database of Systematic Reviews: CD008965. doi:10.1002/14651858.CD008965.pub4. PMID 24718923.
- ^ 抗インフル薬タミフル「効果は限定的」 英医学誌など 朝日新聞 2014-4-11
- ^ Muthuri, Stella G; Venkatesan, Sudhir; Myles, Puja R; et al. (2014). “Effectiveness of neuraminidase inhibitors in reducing mortality in patients admitted to hospital with influenza A H1N1pdm09 virus infection: a meta-analysis of individual participant data”. The Lancet Respiratory Medicine 2 (5): 395–404. doi:10.1016/S2213-2600(14)70041-4. PMID 24815805.
- ^ Leonardi-Bee, Jo; Venkatesan, Sudhir; Muthuri, Stella G; et al. (2014). “Statistical and methodological concerns about the beneficial effect of neuraminidase inhibitors on mortality”. The Lancet Respiratory Medicine 2 (7): e10–e12. doi:10.1016/S2213-2600(14)70137-7. PMID 24948433.
- ^ Butler, Declan (2014). “Tamiflu report comes under fire”. Nature 508 (7497): 439–440. doi:10.1038/508439a. PMID 24759392.
- ^ “「使用上の注意」の改訂について(平成31年3月1日薬生安発0301第1号)” (PDF). 医薬・生活衛生局医薬安全対策課 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律関係. 厚生労働省. p. 2 (2019年3月1日). 2019年3月4日閲覧。
- ^ マルク・アンドレ・ミゼレ、由比かおり・訳 (2014年5月26日). “タミフルは本当に有効なのか?賛否両論の「サクセスストーリー」”. swissinfo.ch. 2018年4月15日閲覧。
- ^ "First Approval of Roche's Tamiflu™, a New Flu Treatment" (Press release). Gilead Sciences. 24 September 1999. 2009年4月29日閲覧。
- ^ "Roche Receives FDA Approval Of TAMIFLU™, First Pill To Treat The Most Common Strains Of Influenza (A&B)" (Press release). Gilead Sciences. 24 September 1999. 2009年10月27日閲覧。
- ^ "Roche update on Tamiflu global supply to meet future world demands – from partnerships to regional sub-licenses" (Press release). Hoffmann-La Roche. 12 December 2005. 2009年4月30日閲覧。
- ^ "Roche grants Tamiflu sub-license to India's Hetero Drugs to make flu medicine for India and developing countries" (Press release). Hoffmann-La Roche. 23 December 2005. 2009年4月30日閲覧。
- ^ a b c d Gupta, YogendraKumar; Meenu, Meenakshi; Mohan, Prafull; et al. (2015). “The Tamiflu fiasco and lessons learnt”. Indian Journal of Pharmacology 47 (1): 11. doi:10.4103/0253-7613.150308. PMC 4375804. PMID 25821304.
- ^ WHO (2007年1月18日). “Avian influenza - situation in Egypt - update”. Global Alert and Response. 2009年4月30日閲覧。2007年1月に WHO が報告した2006年12月エジプトでタミフル耐性の H5N1 の出現例
- ^ 厚生労働省. “感染症発生動向調査における薬剤耐性インフルエンザウイルスについて(中間報告)”. 2009年4月30日閲覧。
- ^ a b c Ward P, Small I, Smith J, Suter P, Dutkowski R. Oseltamivir (Tamiflu) and its potential for use in the event of an influenza pandemic. J Antimicrob Chemother 2005;55 (Suppl 1): i5-i21. PMID 15709056
- ^ a b c d Kiso M, Mitamura K, Sakai-Tagawa Y, Shiraishi K, Kawakami C, Kimura K, et al. Resistant influenza A viruses in children treated with oseltamivir: descriptive study. Lancet 2004;364(9436):759-65. PMID 15337401
- ^ Le Q M; Kiso M, Someya K, Sakai Y T, Nguyen T H, Nguyen K H L, Pham N D, Ngyen H H, Yamada S, Muramoto Y, Horimoto T, Takada A, Goto H, Suzuki T, Suzuki Y, Kawaoka Y. (October 2005). “Avian flu: Isolation of drug-resistant H5N1 virus.”. Nature 437 (1108). doi:10.1038/4371108a.
- ^ World Health Organization. (2005年5月). “WHO inter-country-consultation: influenza A/H5N1 in humans in Asia: Manila, Philippines, 6-7 May 2005.”. October 12, 2005閲覧。
- ^ Moscona, Anne (December 2005). “Perspective - Oseltamivir Resistance - Disabling Our Influenza Defenses.”. NEJM. 353 (25): 2633-2636.
- ^ Okamoto Shigeru; Kamiya I, Kishida K, Shimakawa T, Fukui T, Morimoto T. (Jun 2005). “Experience with oseltamivir for infants younger than 1 year old in Japan.”. Pediatr Infect Dis J. (Lippincott Williams & Wilkins, Inc.) 24 (6): 575-6. ISSN 0891-3668.
- ^ S. Hatakeyama, N. Sugaya, M. Ito, M. Yamazaki, M. Ichikawa, K. Kimura, M. Kiso, H. Shimizu, C. Kawakami, K. Koike, K. Mitamura, Y. Kawaoka. 2007. Emergence of Influenza B Viruses With Reduced Sensitivity to Neuraminidase Inhibitors. JAMA. 297:1435-1442.
- ^ CTV.ca News Staff (2008年2月1日). “Tamiflu-resistant flu found in Canada and U.S.”. CTV.ca 2008年2月1日閲覧。
- ^ 三和護=日経メディカル別冊 (2008年1月8日). “今シーズンのAソ連型タミフル耐性ウイルス、日本で93%に見つかる”. 日経メディカルオンライン. 2010年9月14日閲覧。
- ^ 耐性ウイルスを意識した抗インフルエンザ薬治療を日経メディカル オンライン
- ^ 小児・未成年者がインフルエンザにかかった時は、異常行動にご注意下さい 厚生労働省
- ^ Jefferson T, Jones M, Doshi P, Spencer EA, Onakpoya I, Heneghan CJ. "Oseltamivir for influenza in adults and children: systematic review of clinical study reports and summary of regulatory comments." BMJ. 2014 Apr 9;348:g2545. doi: 10.1136/bmj.g2545. PMID 24811411
- ^ FDA (2005年11月18日). “Pediatric Safety Update for Tamiflu Pediatric Advisory Committee Meeting” (PDF). 2009年4月29日閲覧。
- ^ 厚生労働省医薬食品局安全対策課 (2005年11月18日). “タミフルに係る米国食品医薬品局(FDA)関係情報” (PDF). 厚生労働省. 2009年4月29日閲覧。
- ^ 衞藤義勝 (2005年11月30日). “日本小児科学会におけるタミフルに係わる事項についての見解”. 日本小児科学会. 2009年4月29日閲覧。
- ^ 『インフルエンザ治療に携わる医療関係者の皆様へ』(プレスリリース)厚生労働省、2007年2月28日。2010年9月14日閲覧。
- ^ 『タミフル服用後の異常行動について』(プレスリリース)厚生労働省、2007年3月20日。2010年9月14日閲覧。
- ^ Izumi Y, Tokuda K, O'dell KA, Zorumski CF, Narahashi T. "Neuroexcitatory actions of Tamiflu and its carboxylate metabolite." Neurosci Lett. 2007 Oct 9;426(1):54-8. PMID 17884292
- ^ “平成19年度第5回 薬事・食品衛生審議会 医薬品等安全対策部会 安全対策調査会”. 厚生労働省 (2007年12月25日). 2007年12月26日閲覧。
- ^ 友野順章、城裕之、インフルエンザ罹患時に異常行動を起こした患者ではオセルタミビルを内服している例は多くない 『感染症学雑誌』 2008年 82巻 6号 p.613-618, doi:10.11150/kansenshogakuzasshi1970.82.613
- ^ 池谷裕二、脳回路システムにおける薬効評価系を目指した多ニューロン画像法 『YAKUGAKU ZASSHI.』 2008年 128巻 9号 p.1251-1257, doi:10.1248/yakushi.128.1251
- ^ Limited Brain Distribution of [3R,4R,5S-4-Acetamido-5-amino-3-(1-ethylpropoxy)-1-cyclohexene-1-carboxylate Phosphate (Ro 64-0802), a Pharmacologically Active Form of Oseltamivir, by Active Efflux across the Blood-Brain Barrier Mediated by Organic Anion Transporter 3 (Oat3/Slc22a8) and Multidrug Resistance-Associated Protein 4 (Mrp4/Abcc4)]
- ^ “【大森病院東洋医学科・三浦於菟教授】八角 新型インフル予防に効くって本当?(5/12 日刊ゲンダイ)”. メディア掲載情報. 東邦大学ポータルサイト. 2009年7月21日閲覧。
- ^ Enserink, Martin (April 2006), “Oseltamivir Becomes Plentiful--But Still Not Cheap” (PDF), Science 312: 383, 21 April 2006
- ^ Farina, V.; Brown, J. D. (2006). "Tamiflu: the supply problem." Angew. Chem. Int. Ed. 45: 7330–7334. doi:10.1002/anie.200602623.
- ^ Yeung, Y.-Y.; Hong, S.; Corey, E. J. (2006). "A short enantioselective pathway for the synthesis of the anti-influenza neuramidase inhibitor oseltamivir from 1,3-butadiene and acrylic acid." J. Am. Chem. Soc. 128: 6310–6311. doi:10.1021/ja0616433 10.1021/ja0616433
- ^ Fukuta, Y.; Mita, T.; Fukuda, N.; Kanai, M.; Shibasaki, M. (2006). "De novo synthesis of Tamiflu via a catalytic asymmetric ring-opening of meso-aziridines with TMSN3." J. Am. Chem. Soc. 128: 6312–6313. doi:10.1021/ja061696k 10.1021/ja061696k
- ^ Mita, T.; Fukuda, N.; Roca, F. X.; Kanai, M.; Shibasaki, M. (2007). "Second generation catalytic asymmetric synthesis of Tamiflu: allylic substitution route." Org. Lett. 9: 259–262. doi:10.1021/ol062663c.
- ^ Yamatsugu, K.; Kamijo, S.; Suto, Y.; Kanai, M.; Shibasaki, M. (2007). "A concise synthesis of Tamiflu: third generation route via the Diels–Alder reaction and the Curtius rearrangement." Tetrahedron Lett. 48: 1403–1406. doi:10.1016/j.tetlet.2006.12.093.
- ^ Satoh, N.; Akiba, T.; Yokoshima, S.; Fukuyama, T. (2007). "A practical synthesis of (−)-oseltamivir." Angew. Chem. Int. Ed. 46: 5734–5736. doi:10.1002/anie.200701754.
- ^ Cong X.; Yao, Z.-J. (2006). "Ring-closing metathesis-based synthesis of (3R,4R,5S)-4-acetylamino-5-amino-3-hydroxycyclohex-1-ene-carboxylic acid ethyl ester: a functionalized cycloalkene skeleton of GS4104." J. Org. Chem. 71: 5365–5368. doi:10.1021/jo060633h.
- ^ Bromfield, K. M.; Gradén, H.; Hagberg, D. P.; Olsson T.; Kann, N. (2007). "An iron carbonyl approach to the influenza neuraminidase inhibitor oseltamivir." Chem. Commun. 3183–3185. doi:10.1039/b703295a.
- ^ Shie, J.-J.; Fang, J.-M.; Wang, S.-Y.; Tsai, K.-C.; Cheng, Y.-S. E.; Yang, A.-S.; Hsiao, S.-C.; Su, C.-Y.; Wong, C.-H. (2007). "Synthesis of Tamiflu and its phosphonate congeners possessing potent anti-influenza activity." J. Am. Chem. Soc. 129: 11892–11893. doi:10.1021/ja073992i.
- ^ Hayato Ishikawa, Takaki Suzuki, Yujiro Hayashi (2009). "High-Yielding Synthesis of the Anti-Influenza Neuramidase Inhibitor (-)-Oseltamivir by Three "One-Pot" Operations " Angew. Chem. Int. Ed. 48: 1304. doi:10.1002/anie.200804883.
- ^ Hayato Ishikawa, Takaki Suzuki, Hideo Orita, Tadafumi Uchimaru, Yujiro Hayashi (2010). "High-Yielding Synthesis of the Anti-Influenza Neuraminidase Inhibitor (−)-Oseltamivir by Two “One-Pot” Sequences" "Che,. Eur. J." 16: 12616. doi:10.1002/chem.201001108
- ^ Takasuke Mukaiyama, Hayato Ishikawa , Hiroyuki Koshino, and Yujiro Hayashi (2013). "One-Pot Synthesis of (−)-Oseltamivir and Mechanistic Insights into the Organocatalyzed Michael Reaction" "Che,. Eur. J. Early View. doi:10.1002/chem.201302371
- ^ タミフルのワンポット合成、ついになる、ChemASAP
外部リンク
[編集]この節の外部リンクはウィキペディアの方針やガイドラインに違反しているおそれがあります。 |
- 厚生労働省 - インフルエンザに伴う随伴症状の発現状況に関する調査研究 (PDF) (厚生労働科学研究費補助金平成17年度分担研究報告書)
- 鳥インフルエンザ&新型インフルエンザ情報 (生活環境化学の部屋)
- タミフル承認取り消し要求、または、浜六郎氏の言動はあまりにも危険だと思う(疑似科学批判で知られる菊池誠による、2007/3/27)