Wee1
| Wee1 | |
|---|---|
 ヒトWEE1タンパク質の結晶構造 | |
| 識別子 | |
| 略号 | Mitosis inhibitor protein kinase Wee1 |
| 他の略号 | wee1 dual specificity protein kinase Wee1 |
| Entrez | 2539123 |
| UniProt | P07527 |
| 他のデータ | |
| EC番号 (KEGG) | 2.7.11.1 |
Wee1は、分裂酵母Schizosaccharomyces pombeの核内にみられるプロテインキナーゼである。約96 kDaのタンパク質であり、細胞周期の進行を調節する重要な因子である。Wee1はCdk1(Cdc2)を阻害して有糸分裂の開始を阻害することで、細胞のサイズに影響を及ぼす。Wee1のホモログは、哺乳類を含む多くの生物種に存在する。
概要
[編集]細胞のサイズの調節は、細胞の機能性を保証するうえで重要である。細胞のサイズは、栄養素、成長因子、機能的負荷といった環境因子以外に、cell size checkpointと呼ばれるチェックポイントによっても制御されている。
Wee1はこのチェックポイントの構成要素の1つである。Wee1は有糸分裂へ移行する時点を決定するキナーゼであり、娘細胞のサイズに影響を及ぼす。Wee1の機能が失われると、細胞分裂が早期に生じるため娘細胞のサイズは正常よりも小さくなる。
Wee1の名称は「小さい」を意味するスコットランド英語"wee"に由来し、発見者であるポール・ナースは発見時にスコットランドのエディンバラ大学に勤務していた[1][2]。
機能
[編集]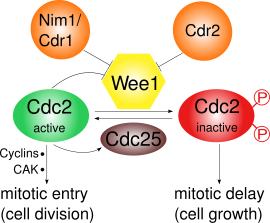
Wee1は、Cdk1の2つの部位、Tyr15とThr14をリン酸化することで阻害する[3]。Cdk1は、さまざまな細胞周期チェックポイントのサイクリン依存性経路に重要である。Wee1によるCdk1の阻害が重要となるチェックポイントは少なくとも3つ存在する。
- G2/Mチェックポイント: Wee1はCdk1のTyr15とThr14をリン酸化してキナーゼ活性を低く保って有糸分裂への移行を阻害し、その結果さらなる細胞成長が生じる場合がある。Wee1によるCdk1の不活性化は、基質の競合による超感受性を示す[4]。有糸分裂の開始時にはWee1の活性はいくつかの調節因子によって低下し、Cdk1の活性は増大する。分裂酵母では、プロテインキナーゼPom1が細胞の極に局在し、Cdr2がCdr1を介してWee1を阻害する経路が活性化される。Cdk1自身もWee1をリン酸化によって負に調節しており、ポジティブフィードバックループが形成されている。Wee1活性の低下だけでは有糸分裂の開始には不十分であり、サイクリンの合成やCDK活性化キナーゼ(CAK)によるリン酸化も必要である[5]。
- Cell size checkpoint: 小さな細胞が有糸分裂を開始することを防ぐチェックポイントが存在する証拠が得られている。このチェックポイントにおいて、Wee1は細胞のサイズと細胞周期の進行を調整する役割を果たしている[6]。
- DNA損傷チェックポイント: このチェックポイントもG2/M期の移行を制御している。分裂酵母では、このチェックポイントはDNA損傷(ガンマ線照射によるものなど)を有する細胞の有糸分裂の開始を遅らせている。G2期の延長はWee1に依存しており、変異体ではガンマ線照射後のG2期の延長がみられない[7]。
Wee1キナーゼのエピジェネティックな機能も報告されている。Wee1はヒストンH2BのTyr37残基をリン酸化し、ヒストンの発現を全般的に調節していることが示されている[8][9]。
ホモログ
[編集]| human WEE1 homolog (S. pombe) | |
|---|---|
| 識別子 | |
| 略号 | WEE1 |
| Entrez | 7465 |
| HUGO | 12761 |
| OMIM | 193525 |
| RefSeq | NM_003390 |
| UniProt | P30291 |
| 他のデータ | |
| 遺伝子座 | Chr. 11 p15.3-15.1 |
| human WEE1 homolog 2 (S. pombe) | |
|---|---|
| 識別子 | |
| 略号 | WEE2 |
| Entrez | 494551 |
| HUGO | 19684 |
| RefSeq | NM_001105558 |
| UniProt | P0C1S8 |
| 他のデータ | |
| 遺伝子座 | Chr. 7 q32-q32 |
ヒトには、WEE1(WEE1A)、WEE2(WEE1B)という2種類のWee1ホモログの存在が知られている。これらはCdk1のホモログであるCDK1に対して作用する。出芽酵母Saccharomyces cerevisiaeのWee1ホモログはSwe1と呼ばれる。
調節
[編集]Cdk1とサイクリンBは成熟促進因子(MPF)を構成し、有糸分裂への移行を促進する。MPFはWee1によるリン酸化によって不活性化され、ホスファターゼCdc25によって活性化される。Cdc25はPoloキナーゼによって活性化され、Chk1によって不活性化される[6]。分裂酵母におけるWee1の調節は主に、Cdr2やCdr1を含むPom1経路によるリン酸化の制御下に置かれている[10][11][12][13]。G2/M期の移行時には、Cdk1はCdc25によるTyr15の脱リン酸化によって活性化され、それと同時にWee1はNim1/Cdr1によるC末端触媒ドメインのリン酸化によって不活性化される[12]。また、活性型MPFはCdc25の活性化とWee1の不活性化によって自身の活性を促進するポジティブフィードバックループを形成するが、その詳細は解明されていない[6]。
高等真核生物においては、Wee1の不活性化はリン酸化と分解の双方によって行われる[14]。タンパク質複合体SCFβ-TrCP1/2はWee1Aのユビキチン化を担うE3ユビキチンリガーゼである。M期キナーゼPlk1とCdc2はWee1Aの2つのセリン残基をリン酸化し、このリン酸化がSCFβ-TrCP1/2によって認識される[15]。
出芽酵母では、サイクリン依存性キナーゼCdc28(Cdk1ホモログ)はSwe1(Wee1ホモログ)によってリン酸化され、Mih1(Cdc25ホモログ)によって脱リン酸化される。Hsl1(Nim1/Cdr1ホモログ)は関連キナーゼGin4、Kcc4とともにSwe1をbud neck(出芽のくびれ部分)へ局在させる。この部位と関連したキナーゼであるCla4とCdc5(Poloキナーゼホモログ)は細胞周期のさまざまな段階でSwe1をリン酸化する。Swe1はClb2-Cdc28によってもリン酸化され、このリン酸化はCdc5によるさらなるリン酸化のための認識シグナルとして機能する。Swe1は分解によっても調節されている。Swe1はClb2-Cdc28とCdc5によって高リン酸化状態となり、このことが高等真核生物と同様にSCFユビキチンリガーゼによるユビキチン化と分解のシグナルとなっている可能性がある[16]。
がんにおける役割
[編集]WEE1はDNA損傷によって誘発されるアポトーシスを阻害する。KLF2はヒトのWEE1の発現を負に調節しており、KLF2の発現はがん細胞のDNA損傷によるアポトーシス感受性を高める[17]。
変異体の表現型
[編集]Wee1は、有糸分裂に対し用量依存的な阻害因子として作用する[18]。そのため、Wee1タンパク質の量は細胞のサイズと相関する。分裂酵母のwee1変異体(wee1−)は、野生型細胞と比較して有意に小さなサイズの時点で分裂する。Wee1は有糸分裂の開始を阻害するため、Wee1が存在しない場合には正常よりも早期の小さなサイズの段階で分裂が引き起こされると考えられる。逆にWee1の発現が増大した場合には有糸分裂は遅延し、細胞はより大きなサイズへと成長する。
出典
[編集]- ^ Nurse P (December 2004). “Wee beasties”. Nature 432 (7017): 557. Bibcode: 2004Natur.432..557N. doi:10.1038/432557a. PMID 15577889.
- ^ “Regulatory genes controlling mitosis in the fission yeast Schizosaccharomyces pombe”. Genetics 96 (3): 627–37. (November 1980). doi:10.1093/genetics/96.3.627. PMC 1214365. PMID 7262540.
- ^ “The Wee1 protein kinase regulates T14 phosphorylation of fission yeast Cdc2”. Mol Biol Cell 6 (4): 371–85. (1995). doi:10.1091/mbc.6.4.371. PMC 301198. PMID 7626804.
- ^ Kim, SY; Ferrell JE, Jr (23 March 2007). “Substrate competition as a source of ultrasensitivity in the inactivation of Wee1.”. Cell 128 (6): 1133–45. doi:10.1016/j.cell.2007.01.039. PMID 17382882.
- ^ “Cdc2 regulatory factors”. Current Opinion in Cell Biology 6 (6): 877–82. (1994). doi:10.1016/0955-0674(94)90060-4. PMID 7880537.
- ^ a b c Kellogg DR (2003). “Wee1-dependent mechanisms required for coordination of cell growth and cell division”. J Cell Sci 116 (24): 4883–90. doi:10.1242/jcs.00908. PMID 14625382.
- ^ “The wee1 protein kinase is required for radiation-induced mitotic delay”. Nature 356 (6367): 353–5. (1992). Bibcode: 1992Natur.356..353R. doi:10.1038/356353a0. PMID 1549179.
- ^ “H2B Tyr37 phosphorylation suppresses expression of replication-dependent core histone genes.”. Nature Structural & Molecular Biology 19 (9): 930–7. (2012). doi:10.1038/nsmb.2356. PMC 4533924. PMID 22885324.
- ^ “WEE1 tyrosine kinase, a novel epigenetic modifier.”. Trends Genet. 29 (7): 394–402. (2013). doi:10.1016/j.tig.2013.02.003. PMC 3700603. PMID 23537585.
- ^ “Replication checkpoint enforced by kinases Cds1 and Chk1”. Science 280 (5365): 909–12. (May 1998). Bibcode: 1998Sci...280..909B. doi:10.1126/science.280.5365.909. PMID 9572736.
- ^ “Nim1 kinase promotes mitosis by inactivating Wee1 tyrosine kinase”. Nature 363 (6431): 738–41. (June 1993). Bibcode: 1993Natur.363..738W. doi:10.1038/363738a0. PMID 8515818.
- ^ a b “Negative regulation of the wee1 protein kinase by direct action of the nim1/cdr1 mitotic inducer”. Cell 72 (6): 919–29. (March 1993). doi:10.1016/0092-8674(93)90580-J. PMID 7681363.
- ^ “Two distinct mechanisms for negative regulation of the Wee1 protein kinase”. EMBO J. 12 (9): 3427–36. (September 1993). doi:10.1002/j.1460-2075.1993.tb06017.x. PMC 413619. PMID 7504624.
- ^ “Regulation of the human WEE1Hu CDK tyrosine 15-kinase during the cell cycle”. EMBO J. 14 (9): 1878–91. (May 1995). doi:10.1002/j.1460-2075.1995.tb07180.x. PMC 398287. PMID 7743995.
- ^ Watanabe N; Arai H; Nishihara Y et al. (March 2004). “M-phase kinases induce phospho-dependent ubiquitination of somatic Wee1 by SCFbeta-TrCP”. Proc. Natl. Acad. Sci. U.S.A. 101 (13): 4419–24. Bibcode: 2004PNAS..101.4419W. doi:10.1073/pnas.0307700101. PMC 384762. PMID 15070733.
- ^ “Monitoring the cell cycle by multi-kinase-dependent regulation of Swe1/Wee1 in budding yeast”. Cell Cycle 4 (10): 1346–9. (October 2005). doi:10.4161/cc.4.10.2049. PMID 16123596.
- ^ Wang F; Zhu Y; Huang Y et al. (June 2005). “Transcriptional repression of WEE1 by Kruppel-like factor 2 is involved in DNA damage-induced apoptosis”. Oncogene 24 (24): 3875–85. doi:10.1038/sj.onc.1208546. PMID 15735666.
- ^ “Negative regulation of mitosis by wee1+, a gene encoding a protein kinase homolog”. Cell 49 (4): 559–67. (May 1987). doi:10.1016/0092-8674(87)90458-2. PMID 3032459.
