向山アルドール反応
| 原料 |
|---|
 アルデヒド (R1 = アルキル、アリール,H,OR,SR) または ギ酸エステル (R1 = OR) |
 シリルエノールエーテル (R1 = アルキル, アリール, H; R2 = アルキル、アリール、H, OR, SR) |
向山アルドール反応(むかいやまアルドールはんのう、Mukaiyama aldol addition)は、1973年に向山光昭によって発明された[1]、ルイス酸触媒を用いたシリルエノールエーテルとカルボニル化合物のアルドール反応である[2]。アルデヒドまたはケトンの交差アルドール反応における自己縮合を防ぐことができるため、有機合成において頻繁に用いられる反応である。
一般的な反応式
[編集]まず、R2 = H の場合の反応式を示す。ただし、触媒はアキラルなものを使用する。この場合、2つのエナンチオマーの混合物(ラセミ体)が得られる。

(E)体または(Z)体のシリルエノールエーテルを用いると、2種類のジアステレオマーの混合物が生成し、4つの立体異性体ができる。

ジアステレオマー比は、反応条件や基質及びルイス酸触媒の種類に大きく依存する。典型的な例として、シクロヘキサノンより誘導したシリルエノールエーテルとベンズアルデヒドの反応が挙げられる。これらの反応により、トレオ体が69%、エリトロ体が19%のジアステレオマー混合比のβ-ヒドロキシケトンが生成し、またアルドール縮合によるエノンが6%得られる。[要出典]
向山アルドール反応は当初量論量のルイス酸触媒(四塩化チタン)が添加されていたが、実際には触媒量でも進行する。また、当反応における不斉合成の研究も進んでいる[3]。
反応機構
[編集]以下に反応機構を示す。R2 = Hであり、ルイス酸触媒として四塩化チタンを使用する。
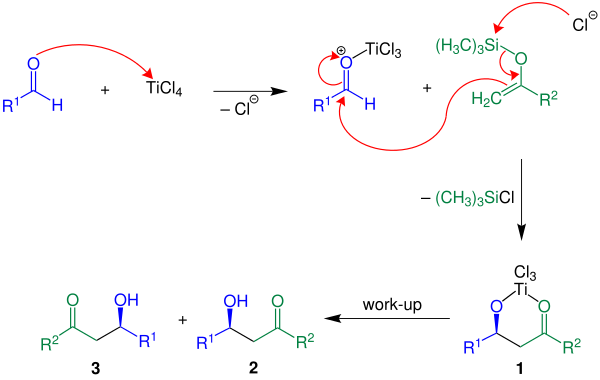
まず、ルイス酸触媒がアルデヒドのカルボニル酸素に配位して活性化する。シリルエノールエーテルが活性化されたアルデヒドに求核攻撃し、炭素-炭素結合が形成される。クロロシランが脱離し、化合物1が生成する。水による処理で目的生成物である2と3のラセミ体を得る[3]。
応用
[編集]二組のケトン同士の反応として、次のアセトフェノンとアセトンの反応が挙げられる[4]。

この反応は通常高温条件が必要である。
脚注
[編集]- ^ New aldol type reaction Teruaki Mukaiyama, Koichi Narasaka and Kazuo Banno Chemistry Letters Vol.2 (1973) , No.9 pp.1011–1014 doi:10.1246/cl.1973.1011
- ^ Mukaiyama, T.; Kobayashi, S. Org. React. 1994, 46, 1. doi:10.1002/0471264180.or046.01
- ^ a b László Kürti und Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 298–299, ISBN 978-0-12-429785-2.
- ^ Organic Syntheses, Coll. Vol. 8, p.323 (1993); Vol. 65, p. 6 (1987). http://www.orgsynth.org/orgsyn/pdfs/CV8P0323.pdf
