ロダネーゼ
| ロダネーゼ様ドメイン | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 識別子 | |||||||||
| 略号 | Rhodanese | ||||||||
| Pfam | PF00581 | ||||||||
| InterPro | IPR001763 | ||||||||
| PROSITE | PDOC00322 | ||||||||
| SCOP | 2ora | ||||||||
| SUPERFAMILY | 2ora | ||||||||
| OPM superfamily | 413 | ||||||||
| OPM protein | 2mpn | ||||||||
| CDD | cd00158 | ||||||||
| Membranome | 571 | ||||||||
| |||||||||
ロダネーゼ (Rhodanese) は、シアン化物イオン(CN-) をチオシアン酸イオン (SCN-) に変換することで解毒するミトコンドリア酵素である[1]。
反応は2段階で進行する。右図では、X線結晶構造解析で決定された構造を示している。第1段階では、チオ硫酸イオンがシステイン-247のチオール基(1)により還元され、過硫化物(2)と亜硫酸イオンに変換される。第2段階では、過硫化物がシアン化物イオンと反応してチオシアン酸イオンが形成され、システインのチオール(1)が再生される[2]。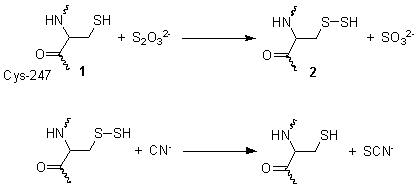
形成されるチオシアン化物の毒性は約1/200であるため、この反応は、シアン化物への曝露の治療にとって重要である[3]:p. 15938。シアン化物中毒の解毒剤としてのチオ硫酸塩溶液の利用は、この酵素サイクルの活性化に基づいている。
ロダネーゼは、以下のようなタンパク質を含む大きなファミリーと進化的な関係を持つ。
- Cdc25 phosphatase catalytic domain
- non-catalytic domains of eukaryotic dual-specificity MAPK-phosphatases
- non-catalytic domains of yeast PTP-type MAPK-phosphatases
- non-catalytic domains of yeast Ubp4, Ubp5, Ubp7
- non-catalytic domains of mammalian Ubp-Y
- Drosophila heat shock protein HSP-67BB
- several bacterial cold-shock and phage shock proteins
- plant senescence associated proteins
- catalytic and non-catalytic domains of rhodanese[4]
ロダネーゼでは遺伝子内重複が生じており、ロダネーゼ様ドメインはホスファターゼやユビキチンC末端ヒドロラーゼなど他のタンパク質では単一コピーで存在している[5]。
このドメインを含むヒトタンパク質
[編集]CDC25A; CDC25B; CDC25C; DUSP; DUSP1; DUSP10; DUSP16; DUSP2; DUSP4; DUSP5; DUSP6; DUSP7; KAT; MKP7; MOCS3; MPST; TBCK; TSGA14; TST; USP8;
名前
[編集]酵素の命名の標準的なルールにしたがうと、名前は「アーゼ」で終わるはずだが、ロダネーゼは、国際生化学・分子生物学連合の酵素委員会が設立される1955年より前の1933年に最初に記載されており[6]、この名前が既に広く用いられていたことから、そのままとなった。
チオ硫酸硫黄転移酵素
[編集]チオ硫酸硫黄転移酵素 (EC 2.8.1.1) は、以下の化学反応を触媒する酵素である。
- チオ硫酸塩 + シアン化物 亜硫酸塩 + チオシアン酸塩
従って、この酵素の2つの基質は、チオ硫酸塩とシアン化物、2つの生成物は亜硫酸塩とチオシアン酸塩である。
出典
[編集]- ^ “Enzymatic detoxification of cyanide: clues from Pseudomonas aeruginosa Rhodanese”. Journal of Molecular Microbiology and Biotechnology 15 (2–3): 199–211. (2008). doi:10.1159/000121331. PMID 18685272.
- ^ “Enzymatic detoxification of cyanide: clues from Pseudomonas aeruginosa Rhodanese”. Journal of Molecular Microbiology and Biotechnology 15 (2–3): 199–211. (2008). doi:10.1159/000121331. PMID 18685272.
- ^ “Cyanides in the environment-analysis-problems and challenges”. Environmental Science and Pollution Research International 24 (19): 15929–15948. (July 2017). doi:10.1007/s11356-017-9081-7. PMC 5506515. PMID 28512706.
- ^ “Thiosulphate sulfurtransferase, conserved site (IPR001307)” (英語). EMBL-EBI. InterPro. 2022年8月14日閲覧。
- ^ Gliubich, F.; Gazerro, M.; Zanotti, G.; Delbono, S.; Bombieri, G.; Berni, R. (1996-08-30). “Active site structural features for chemically modified forms of rhodanese”. The Journal of Biological Chemistry 271 (35): 21054–21061. doi:10.1074/jbc.271.35.21054. ISSN 0021-9258. PMID 8702871.
- ^ “Common themes and variations in the rhodanese superfamily”. IUBMB Life 59 (2): 51–9. (February 2007). doi:10.1080/15216540701206859. PMID 17454295.
外部リンク
[編集]- Rhodanese - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス

