ホモゲンチジン酸-1,2-ジオキシゲナーゼ
| ホモゲンチジン酸-1,2-ジオキシゲナーゼ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 識別子 | |||||||||
| EC番号 | 1.13.11.5 | ||||||||
| CAS登録番号 | 9029-49-6 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| 遺伝子オントロジー | AmiGO / QuickGO | ||||||||
| |||||||||
| ホモゲンチジン酸-1,2-ジオキシゲナーゼ(ホモゲンチジン酸オキシダーゼ) | |
|---|---|
| 識別子 | |
| 略号 | HGD |
| 他の略号 | AKU |
| Entrez | 3081 |
| HUGO | 4892 |
| OMIM | 607474 |
| RefSeq | XM_001125882 |
| UniProt | Q93099 |
| 他のデータ | |
| EC番号 (KEGG) | 1.13.11.5 |
| 遺伝子座 | Chr. 3 q21-q23 |
ホモゲンチジン酸-1,2-ジオキシゲナーゼ (homogentisate 1,2-dioxygenase, HGD) は、ホモゲンチジン酸を4-マレイルアセト酢酸に変換する酵素である。HGDは芳香環の異化に関連する酵素で、チロシンとフェニルアラニンの分解に特異的であり[1]、それぞれの代謝経路を構成している。基質であるホモゲンチジン酸も生成物である4-マレイルアセト酢酸も代謝経路に用いられる。HGDはホモゲンチジン酸の芳香環を開裂させるためにFe2+とO2を必要とする[2]。
活性部位
[編集]ホモゲンチジン酸-1,2-ジオキシゲナーゼの活性部位はTitusらの研究によりその結晶構造から究明されている[1]。活性部位の結晶構造ではHis292, His335, His365, His371, および Glu341のそれぞれのアミノ酸残基が見られる。

ホモゲンチジン酸はFe2+原子を仲介に活性部位のGlu341, His335, および His371の部分に結合する。ここでHis292は芳香環のヒドロキシル基に結合する。His365はGlu341に水素結合で結合することによりアミノ酸側鎖が安定する。
反応機構
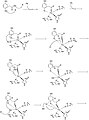
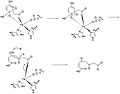
[編集]Borowskiらは米国化学会誌においてHGDの反応機構を提唱している。彼らは反応機構をGAUSSIANとJaguarのプログラムを用い、DFT法(B3LYP)によって演算を行った[2]。
ホモゲンチジン酸の芳香環の開裂は多段階からなり、まずFe2+がカルボニル基とオルトフェノール酸素に配位する。鉄原子はこの他にHis335, His371, および Glu341にも配位している。これに酸素分子が鉄原子に結合し[2]、芳香環はペルオキソ架橋中間体に変化する。酸素分子は開裂しエポキシドを形成する。このエポキシド中間体はラジカル反応により開裂し、六員環は酸化される。
-
反応機構1~8段階目
-
反応機構9~11段階目
脚注
[編集]- ^ a b Titus, Greg P (2000). “Crystal structure of human homogentisate dioxygenase”. Nature Structural Biology 7 (7): 542–546. doi:10.1038/76756.
- ^ a b c Borowski, Tomasz (2005). “Catalytic Reaction Mechanism of Homogentisate Dioxygenase: A Hybrid DFT Study”. J. Am. Chem. Soc. 127: 17303–17314. doi:10.1021/ja054433j.