ブロモチモールブルー
| ブロモチモールブルー | |
|---|---|
| |

| |
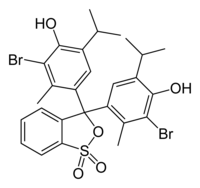
4,4'-(1,1-dioxido-3H-2,1-benzoxathiole-3,3-diyl)bis(2-bromo-6-isopropyl-3-methylphenol) | |
| 識別情報 | |
| CAS登録番号 | 76-59-5 |
| PubChem | 6450 |
| ChemSpider | 6208 |
| UNII | VGU4LM0H96 |
| |
| |
| 特性 | |
| 化学式 | C27H28Br2O5S |
| モル質量 | 624.38 g mol−1 |
| 密度 | 1.25 g/cm3 |
| 融点 |
202 °C, 475 K, 396 °F |
| 水への溶解度 | わずかに溶ける[1] |
| 酸解離定数 pKa | 7.5[2] |
| 危険性 | |
| 安全データシート(外部リンク) | http://www.sciencelab.com/msds.php?msdsId=9927468 |
| NFPA 704 | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
| ブロモチモールブルー (pH指示薬) | ||
| pH 6.0以下 | pH 7.6以上 | |
| 6.0 | ↔ | 7.6 |

ブロモチモールブルーもしくはブロムチモールブルー、ブロモチモールスルホンフタレイン(英: bromothymol blue, BTB)は、分析化学でよく用いられる酸塩基指示薬(pH指示薬)のひとつで、分子式 C27H28Br2O5S で表される、淡黄色または淡紅色の粉末である。しばしば水溶液はBTB溶液と呼ばれる。酸と塩基を判別する指示薬として、ナトリウム塩の形で市販されている。
構造と性質
[編集]分子量は 624.38、pKa は 7.5 であり、pH 7の中性付近に変色点を持つ。水溶液中においてはスルトン環が開環した構造をとり、pHに応答して色調が変化する。色の変化は pH < 6.0で黄色(酸性型)、pH > 7.6 で青色(塩基性型)であり、その中間では緑色を示す。ただし、非常に強い酸に対しては赤色(マゼンタ)を、非常に強い塩基に対しては紫色を示す。中性水溶液中でBTBが緑色を示すのは、酸性型と塩基性型の両方が混ざり合っているためである[2]。
酸性型のBTBは吸光強度の極大が波長433 nmにあるため、酸性溶液中ではBTBは黄色を呈する。一方、塩基性型のBTBは616 nmの光を最もよく吸収し、その結果塩基性溶液中では青色に見える[2]
BTBはトリアリールメタン系色素に分類され、 クロロフェノールレッド(英語版)、チモールブルーやブロモクレゾールグリーン(英語版)など多くの酸塩基指示薬と共通の骨格を有する[3]。
他のトリアリールメタン系色素との変色域の差異は骨格上の置換基の効果によるものである。求電子性の臭素原子と2つの電子供与性の置換基(アルキル基)を持つため、BTBの変色域は6.0から 7.6となる[3]。
- 酸性 ← (赤) − 黄 − 緑 − 青 − (紫) → 塩基性

BTBは水には溶けにくいが、エタノールなどのアルコールやアルカリ水溶液には溶ける。ベンゼンやトルエン、キシレンなどの非極性溶媒には溶けにくく、石油エーテルにはほとんど溶けない[4]。
調製
[編集]酸塩基指示薬として用いる場合、0.02 M 水酸化ナトリウム水溶液 8 cm3にBTBを0.10 gを溶解させ、250 cm3の水で希釈する。容積測定の指示薬として使うときは、50%(v/v)含水エタノール100 cm3にBTBを0.1 gを溶解させて調製する[4]。
用途
[編集]
中性付近の弱酸や塩基の検出に用いられる。プールや養殖槽などでカルボン酸の検出などに使われる。
生物学でスライドを染色する際に使用されることもある。この場合、青色の水溶液としてサンプルに数滴加え、細胞壁や核を青色に染める。
植物の光合成や呼気の観察のための実験として、中性のBTB溶液にチューブで息を吹き込むというものが知られる。呼気に含まれる二酸化炭素が溶解することによって炭酸が生じ、溶液は酸性になるため、緑から黄色へと変化する[5][6]。
BTBは、フェノールレッドと混ぜてアスパラギナーゼという酵素の活性を調べるのに用いられる。酵素がはたらくと、pHが上昇し、フェノールレッドはピンクに、BTBは青に変わる。しかし、最近の研究では、酵素がはたらくとともに黄色の環ができるメチルレッドの方が適していると言われている[7]。
脚注
[編集]- ^ “アーカイブされたコピー”. 2015年11月26日時点のオリジナルよりアーカイブ。2015年12月11日閲覧。
- ^ a b c Shimada, Toru; Hasegawa, Takeshi (October 2017). “Determination of equilibrium structures of bromothymol blue revealed by using quantum chemistry with an aid of multivariate analysis of electronic absorption spectra”. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy 185: 104–110. doi:10.1016/j.saa.2017.05.040 6 January 2022閲覧。.
- ^ a b De Meyer, Thierry (March 2014). “Substituent effects on absorption spectra of pH indicators: An experimental and computational study of sulfonphthaleine dyes”. Dyes and Pigments 102: 241–250. doi:10.1016/j.dyepig.2013.10.048 18 November 2014閲覧。.
- ^ a b O'Neil, Maryadele J (2006). The Merck Index. Merck Research Laboratory. pp. 1445. ISBN 978-0-911910-00-1
- ^ Sabnis R. W. (2007). Handbook of Acid-Base Indicators. CRC Press. ISBN 0-8493-8218-1
- ^ Sabnis R. W. (2010). Handbook of Biological Dyes and Stains: Synthesis and Industrial Applications (1st ed.). Wiley. ISBN 0-470-40753-0
- ^ Dhale, Mohan (July 2014). “A comparative rapid and sensitive method to screen l-asparaginase producing fungi”. Journal of Microbiological Methods 102: 66–68. doi:10.1016/j.mimet.2014.04.010 18 November 2014閲覧。.
関連項目
[編集]外部リンク
[編集]- BTB溶液 理科ねっとわーく(一般公開版) - ウェイバックマシン(2017年10月6日アーカイブ分) - 文部科学省 国立教育政策研究所
- J.T.Baker MSDS
- ブロモチモールブルー(ナトリウム塩) - シグマ・アルドリッチ
- ブロモチモールブルー MSDS (PDF)
- ブロモチモールブルー (試薬) JISK8842:2012

