フォージャサイト
| フォージャサイト | |
|---|---|
 | |
| 分類 | ゼオライト |
| シュツルンツ分類 | 9.GD.30 |
| 化学式 | (Na2,Ca,Mg)3.5Al7Si17O48·32H2O[1] |
| 結晶系 | 立方晶 |
| 対称 | Fd3m |
| 単位格子 | a = 24.638–24.65 Å, Z = 32 |
| 晶癖 | サイズが 4mm以下の八面体またはまれに切頂八面体結晶 |
| 双晶 | on {111}, contact and penetration twins |
| へき開 | {111} |
| 断口 | 不均一から貝殻状 |
| 粘靱性 | 脆い |
| モース硬度 | 4.5-5 |
| 光沢 | ガラス質から金剛質 |
| 色 | 無色 |
| 条痕 | 白色 |
| 透明度 | 透明 |
| 比重 | 1.92–1.93 |
| 光学性 | 等方性 |
| 屈折率 | n = 1.466–1.480 |
| 多色性 | なし |
| 文献 | [2][3][4] |
| プロジェクト:鉱物/Portal:地球科学 | |
フォージャサイト、またの名をフォージャス沸石(フォージャスふっせき、英: faujasite)とは、ゼオライトに属するケイ酸塩鉱物の一つ。合成ゼオライトのモレキュラーシーブおよびハイシリカゼオライトの主要な一群でもある。骨格コードはFAU (faujasite) である[5]。
天然の鉱物としては世界の数箇所でしか確認されていない珍しいものである。含有する陽イオンの違いによりフォージャサイト-Na、フォージャサイト-Mgおよびフォージャサイト-Caが知られる。これらの基本化学組成は(Na2,Ca,Mg)3.5Al7Si17O48·32H2Oであり、陽イオン含有量は実際にはさまざまである[1]。
工業的には重要な材料で、人工的な合成法が確立されている。比較的アルミニウム (Al) 含有量が多いものは (ca. Si/Al < 2) はゼオライトXと呼ばれ、前者は高いイオン交換容量および親水性を持つ吸着剤として重要であり、モレキュラーシーブとして13Xの名称で普及している。一方、Al量が少ないもの (ca. Si/Al > 2) はゼオライトYと呼ばれる。ゼオライトY自体も吸着剤等として使われるが、後処理によりさらにAl量を減らしたものはUSYと呼ばれ、石油化学産業における流動接触分解の固体酸触媒として使われる事から工業的に非常に重要な材となっている。
発見
[編集]フォージャサイトは1842年にドイツのバーデン=ヴュルテンベルク州の低山帯カイザーシュトゥール(Kaiserstuhl)にあるリンベルクという採石場およびザスバッハ(Sasbach)で最初に発見された。フォージャサイト-Ca、フォージャサイ-Mgに続き、フォージャサイト-Na[3]が1990年台になり見つかった。鉱物名の由来はフランスの地質学者であるバルテルミー・フォジャ・ド・サン=フォン(1741年–1819年)に由来する[4]。
フォージャサイトは玄武岩、フォノライト溶岩および凝灰岩中に変質鉱物または自生鉱物として存在する。ほかのゼオライトや、カンラン石、オージャイトおよびネフェリンなどと混合して存在する[2]。
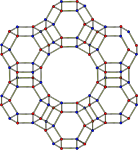
構造
[編集]フォージャサイトの骨格構造はソーダライトケージと呼ばれる切頂八面体構造が六角柱を形成するように連なることで形成する。細孔は結晶内に3次元に広がっている。酸素12員環からなる細孔の大きさは約7.4 Åである。細孔内に存在するケージの直径は12 Åであり、これは10のソーダライトケージに囲まれて形成する。単位格子は立方晶であり、ヘルマン・モーガン記号はCF576、対称性はFd3m, No.227である[6]。格子定数は24.7 Åである。
-
フォージャサイトの骨格構造の前面図
合成
[編集]フォージャサイトは他のゼオライトと同様に、アルミン酸ナトリウムなどのアルミニウム源とケイ酸ナトリウムなどのシリカ源から合成される。カオリナイトなどの他のアルミノケイ酸塩も原料として使われる。これらの原料を水酸化ナトリウム水溶液などのアルカリ条件下で溶解させ、およそ70から300 °C (典型的には100 °C) の条件下で結晶化させる。
一般にゼオライトはSi/Al比が高くなるにつれ安定性が向上することから、比較的Alの少ないゼオライトYは高温条件下で安定な固体酸触媒として利用できる。まずNa+型のゼオライトYをアンモニウム (NH4+) 型へイオン交換処理をする。その後500 °C以上で加熱するとアンモニア (NH3) が脱離し、プロトン (H+) 型となる。
ゼオライトYに対し水蒸気処理および酸処理により脱アルミニウムをするとさらに安定化できる。こうして得られたものはUSY(Ultra Stable Y)ゼオライトと呼ばれ、工業的に重要な触媒である。さらに徹底的に脱アルミニウム処理を行うとシリカ (SiO2) に近いフォージャサイトが得られる[7]。
用途
[編集]フォージャサイト、特にゼオライトYは重油からガソリンや軽油といった軽質な炭化水素を得る流動接触分解の触媒として使われる。白金やパラジウムを担持させ水素化分解に用いることもでき[7]、芳香族に富んだ生成物を得ることができる。
一方、ゼオライトXは吸着剤として有用である。比較的大きな分子の吸着に使われるモレキュラーシーブ13Xとして知られる。また、ガス流からCO2を選択的に吸着することが報告されている[8]。空気分離において空気の予備精製に使われている。
脚注
[編集]- ^ a b “Faujasite Subgroup” (英語). www.mindat.org. 2011年6月23日閲覧。
- ^ a b J.W. Anthony; R.A. Bideaux; K.W. Bladh; M.C. Nichols (2001). “Faujasite (Na2; Ca)Al2Si4O12・8H2O” (英語). Handbook of Mineralogy (Mineral Data Publishing) V.. "(1) Kaiserstuhl, Germany. (2) San Bernardino Co., California, USA; by electron microprobe, average of 15 analyses, H2O by difference, corresponding to (Na0:52Ca0:47Mg0:10K0:02)Σ=1:11<・sub> Al1:78Si4:24O12・16H2O."
- ^ a b “Faujasite-Na” (英語). www.mindat.org. 2011年6月23日閲覧。
- ^ a b “Faujasite-Ca Mineral Data” (英語). Webmineral. 2008年8月3日閲覧。 “Faujasite-Ca
(Ca,Na2,Mg)3.5[Al7Si17O48]•32(H2O)
Dana No: 77.01.02.07a Strunz No: 09.GD.30” - ^ “Database of Zeolite Structures” (英語). www.iza-structure.org (2024年2月20日). 2011年7月23日閲覧。
- ^ Hriljac J.A.; Eddy M.M.; Cheetham A.K.; Donohue J.A.; Ray G.J. (1993). “Powder Neutron Diffraction and 29Si MAS NMR Studies of Siliceous Zeolite-Y”. Journal of Solid State Chemistry 106: 66-72. Bibcode: 1993JSSCh.106...66H. doi:10.1006/jssc.1993.1265.
- ^ a b Scherzer, Julius (1989). “Octane-Enhancing, Zeolitic FCC Catalysts: Scientific and Technical Aspects” (英語). Catalysis Reviews 31 (3): 215. doi:10.1080/01614948909349934.
- ^ A1 USA US20020178914 A1, Timothy Golden, "Process for reducing the level of carbon dioxide in a gaseous mixture", published Dec 5, 2002
参考文献
[編集]- Subhash Bhatia (1990) (英語). Zeolite Catalysis: Principles and Applications. Boca Raton, Florida: CRC Press, Inc.
- Ribeiro, F. R.; et al., eds (1984) (英語). Zeolites: Science and Technology. The Hague: Martinus Nijhoff Publishers