III型分泌装置
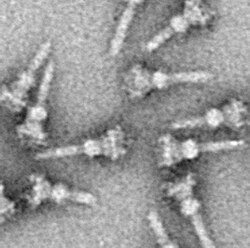
III型分泌装置(さんがたぶんぴつそうち、英: type III secretion system、略称: T3SSまたはTTSS)とは菌体外へタンパク質を分泌させるためにある種の細菌が持つ、注射器のような分泌装置の1つである。細菌の運動に用いる鞭毛と配列類似性が高いため鞭毛が変化してIII型分泌装置になったと考えられている。III型分泌装置はエフェクターと呼ばれるタンパク質を細胞に打ち込むことで宿主細胞への侵入やマクロファージでの生存などに関わっており、細菌が病原性を発揮する上で大きなかぎとなっている。
III型分泌装置を持つ細菌
[編集]など。
構造
[編集]
III型分泌装置の構造は菌体を界面活性剤で処理して精製し電子顕微鏡で観察するところから明らかにされた[1]。それによると、細菌の外膜や内膜に局在しリング状の構造をした基部と呼ばれる部位と、針状に菌体外に突き出たニードルと呼ばれる部位に分けられる。さらに基部は内膜リング、外膜リングとその2つを連結するロッド構造から構成されている。このニードルが対象となる細胞に接触し、エフェクターが細いニードルの中を通って輸送される。実際には先に膜形成因子という細胞膜に穴をあけるタンパク質が分泌されて孔を形成してからエフェクターが打ち込まれる。また、ニードルの中の通り道は細く狭いので基部側にはシャペロンが存在しており、タンパク質をほどいた状態でニードルの中を通すと考えられている[2]。ニードルの長さはそれぞれの細菌によって異なっており、ペスト菌が約40 nm、サルモネラや赤痢菌はだいたい50 nmであるのに対し、腸管病原性大腸菌(EPEC)のそれは短いものは60 nmから長いものは700 nm(平均90 nm)である。それぞれの細菌でニードルの長さを決めているタンパク質があるとされるが、ペスト菌などのエルシニア属の場合はYscPというタンパク質であり、YscPの分子量を変えると、ニードルの長さが変わることが知られている[3]。
機能
[編集]III型分泌装置の働きはエフェクターのタンパク質を標的となる細胞に打ち込み何らかの変化を引き起こすことである。その変化はエフェクターにより異なるが、おもな作用を挙げると、細胞膜の孔形成、細胞への侵入、抗貪食作用、細胞毒性がある。サルモネラの場合は、SopEがRac1、Cdc42のグアニンヌクレオチド交換に関わり[4][5]細胞侵入に関わる一方で、SpiCはTassCに結合してファゴソームとリソソームの融合を阻害するとされる[6]。
創薬
[編集]III型分泌装置は新たな抗菌薬のターゲットとして注目を浴びており、現在模索が続けられている。実際、グアジノミンというストレプトマイセスが産生する物質はIII型分泌装置を阻害し、静菌的に働くことが知られている[7]。
脚注
[編集]- ^ Kubori T, Matsushima Y, Nakamura D, Uralil J, Lara-Tejero M, Sukhan A, Galán JE, Aizawa SI (1998). “Supramolecular structure of the Salmonella typhimurium type III protein secretion system”. Science 280 (5363): 602-605. doi:10.1126/science.280.5363.602. PMID 9554854.
- ^ Galán JE, Wolf-Watz H (2006). “Protein delivery into eukaryotic cells by type III secretion machines”. Nature 444 (7119): 567-573. doi:10.1038/nature05272. PMID 17136086.
- ^ Laure Journet, Céline Agrain, Petr Broz and Guy R. Cornelis (2003). “The Needle Length of Bacterial Injectisomes Is Determined by a Molecular Ruler”. Science 302 (5651): 1757-1760. doi:10.1126/science.1091422. PMID 14657497.
- ^ Rudolph MG, Weise C, Mirold S, Hillenbrand B, Bader B, Wittinghofer A, Hardt WD (1999). “Biochemical analysis of SopE from Salmonella typhimurium, a highly efficient guanosine nucleotide exchange factor for RhoGTPases”. J. Biol. Chem. (43): 30501-9. doi:10.1074/jbc.274.43.30501. PMID 10521431.
- ^ Schlumberger MC, Friebel A, Buchwald G, Scheffzek K, Wittinghofer A, Hardt WD (2003). “Amino acids of the bacterial toxin SopE involved in G nucleotide exchange on Cdc42”. J. Biol. Chem. 278 (29). doi:10.1074/jbc.M302475200. PMID 12719429.
- ^ Aaron H. Lee, Mahboubeh Papari Zareei, Simon Daefler (2002). “Identification of a NIPSNAP homologue as host cell target for Salmonella virulence protein SpiC”. Cell. Microbiol. 4 (11): 739-750. doi:10.1046/j.1462-5822.2002.00225.x. PMID 12427096.
- ^ Iwatsuki M, Uchida R, Yoshijima H, Ui H, Shiomi K, Matsumoto A, Takahashi Y, Abe A, Tomoda H, Omura S (2008). “Guadinomines, Type III secretion system inhibitors, produced by Streptomyces sp. K01-0509. I: taxonomy, fermentation, isolation and biological properties”. J Antibiot. 61 (4): 222-229. doi:10.1038/ja.2008.32. PMID 18503201.
