スクロース
| スクロース | |
|---|---|

| |
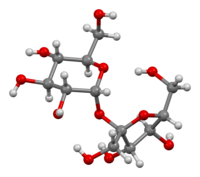
| |
β-D-フルクトフラノシル α-D-グルコピラノシド | |
(2R,3R,4S,5S,6R)-2-{[(2S,3S,4S,5R)-3,4-ジヒドロキシ-2,5-ビス(ヒドロキシメチル)オキソラン-2-イル]オキシ}-6-(ヒドロキシメチル)オキサン-3,4,5-トリオール | |
別称
| |
| 識別情報 | |
| CAS登録番号 | 57-50-1 |
| PubChem | 5988 |
| ChemSpider | 5768 |
| UNII | C151H8M554 |
| EC番号 | 200-334-9 |
| DrugBank | DB02772 |
| KEGG | C00089 |
| ChEBI | |
| ChEMBL | CHEMBL253582 |
| 5411 | |
| RTECS番号 | WN6500000 |
| |
| |
| 特性 | |
| 化学式 | C12H22O11 |
| モル質量 | 342.30 g/mol |
| 外観 | 白色固体 |
| 密度 | 1.587 g/cm3 (0.0573 lb/cu in), solid |
| 融点 |
無し;分解点 186 °C (367 °F; 459 K) |
| 水への溶解度 | ~200 g/dL (25 °C (77 °F)) |
| log POW | −3.76 |
| 構造 | |
| 結晶構造 | 単斜晶系 |
| 空間群 | P21 |
| 熱化学 | |
| 標準生成熱 ΔfH |
−2,226.1 kJ/mol (−532.1 kcal/mol)[1] |
| 標準燃焼熱 ΔcH |
1,349.6 kcal/mol (5,647 kJ/mol)[2] (高位発熱量) |
| 危険性 | |
| 安全データシート(外部リンク) | ICSC 1507 |
| NFPA 704 | |
| 許容曝露限界 | TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp)[4] |
| 半数致死量 LD50 | 29700 mg/kg (oral, rat)[3] |
| 関連する物質 | |
| 関連物質 | ラクトース マルトース |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |

スクロース(英語: sucrose)またはショ糖(蔗糖、しょとう)とは、グルコース(ブドウ糖)とフルクトース(果糖)とがα-1,2-グリコシド結合で結合した二糖である。砂糖の主成分として知られており、テンサイやサトウキビなどから得ることができる。なお「蔗糖」の「蔗」は、訓読みで「さとうきび」と読む[5]。
性質
[編集]スクロースは、他の二糖類と同様に、無色結晶、甘味を有する、水に溶けるなどの性質を有している。加水分解するとグルコースとフルクトースを生じる。
水溶性が高く、25 ℃において、1 gの水に2.1 g溶ける[6]。
先進国における主要な甘味料であり、砂糖の主成分である。一般にはサトウキビや、サトウダイコン(テンサイ)から抽出し、純度を高め結晶化したものである。原料としては他にソルガム(モロコシ)とサトウカエデがある。ちなみにショ糖の結晶を大きく成長させると氷砂糖になる。
約170 ℃に加熱すると、カラメル(キャラメル)と呼ばれる褐色の物質に変化する。カラメルは食用となり、独特の香りを持つ。カラメルはカスタードプディングやカラメルミルクなどに使用される。
人体における消化
[編集]スクロースは、小腸壁に存在する消化酵素「サッカラーゼ(インベルターゼ)」によりグルコースとフルクトースに加水分解され(詳細は「転化糖」を参照)、小腸で吸収されて血流に入る。この反応は短時間で起こるため、血糖値を急激に上昇させる。
健康への影響
[編集]スクロースは、健康に悪影響を及ぼすことがある。その代表的なものはう蝕(むし歯)である。口腔内の細菌がスクロースを材料としてエナメル質や象牙質といった歯質を破壊する酸を産生するためである。特に甘味を求め、スクロースの摂取量が増加し、なおかつ口腔内の清掃が比較的行き届いていない子供において問題となる。
また、一般にスクロースはエネルギー(いわゆるカロリー)が高く、肥満の原因になり、糖尿病患者はスクロースの場合も摂取の制限をしなければならない。また、スクロースで180 g程度以上を一気に摂取すると健常人であっても一過性の糖尿[注釈 1]を生ずる可能性がある。この量は、食品成分表のコーラ・缶コーヒーなどに示される量を基にすると2.5 リットル前後の量(約1100 kcal)に相当する。
代用甘味料
[編集]上記のような健康への影響からスクロースを避けたいというニーズに応えるため、代用甘味料がいくつも開発されてきた。しかし、例えばアスパルテームは加熱することで甘みが低下するなど、調理用に砂糖の代替として利用するのが難しいものがある。また、他の健康上の問題をも引き起こすものもあり、その安全性が疑問視されている。
スクロースを塩素化した甘味料にスクラロースがある。これは有機塩素化合物であり、スクロースの約600倍の甘さ(甘味度)がある食品添加物である。
化学的性質
[編集]化学式は C12H22O11 であり、グルコースとフルクトースがα-1,2-グリコシド結合した二糖類である。組織名は β-D-フルクトフラノシル-(2↔1)-α-D-グルコピラノシド (β-D-fructofuranosyl-(2↔1)-α-D-glucopyranoside) である。語尾が「- オシド ( -oside)」になっているのは還元糖ではないためである。グルコースのアルデヒド基とフルクトースのケトン基が共にグリコシド結合のため酸化されず、二糖類としてはトレハロースと同じように例外的に還元性を持たない。なお多糖類には共通の性質として還元性がない。
また、角砂糖に火を近づけても溶けたり焦げたりするだけで燃焼は起きないが、灰をかけて火を近づけると触媒反応によって燃焼が起こる。
砂糖水試験
[編集]発作性夜間ヘモグロビン尿症を発症しているかどうかを調べる検査手法の1つとして、砂糖水試験あるいはショ糖溶血試験[7](英語: sugar water test)という手法が存在する[8]。
具体的には、血液と等張なスクロース水溶液を作成し[注釈 2]、そこに被験者の赤血球を加えてから室温で1 時間放置した時に、どれだけ溶血したかを調べる[8]。スクロース水溶液のような事実上イオンを含まない溶液中に赤血球を放り込むと、血中に含まれている補体が赤血球の表面に結合しやすくなる[8]。このため膜侵襲複合体も形成しやすくなり、赤血球の細胞膜に穴が作られて、溶血が起こりやすくなる。
もしも、溶血した赤血球が10 %以上だった場合は、砂糖水試験陽性とされ[8]、発作性夜間ヘモグロビン尿症の疑いと判断される。逆に、溶血した赤血球が5 %以下ならば、砂糖水試験陰性とされる[8]。
このように、比較的簡便で費用も安い試験法ながら、必ずしも発作性夜間ヘモグロビン尿症だけを原因として、砂糖水試験が陽性になるとは限らない。例えば、様々な理由で溶血しやすくなっている者の赤血球でも、砂糖水試験が陽性となる場合もあるという問題が知られている[8]。
注釈
[編集]- ^ 糖分の多い食品(特にスポーツドリンクや清涼飲料水)によりスクロースを一度に大量に摂取することに起因する一過性の糖尿は、「ペットボトル症候群」や「清涼飲料水ケトーシス」として言及されることがある。
- ^ 約0.154(mol/リットル)のスクロース水溶液を作れば、生理食塩水と等張になる。したがって、約52.7 gのスクロースを、1 リットルの水に溶かせば良い。
出典
[編集]- ^ Haynes, W. M.; Lide, David R.; Bruno, Thomas J., eds (2014–2015). CRC Handbook of Chemistry and Physics (95th ed.). CRC Press. pp. 5–40. ISBN 978-1482208672
- ^ CRC Handbook of Chemistry and Physics, 49th edition, 1968–1969, p. D-188.
- ^ “57-50-1 - CZMRCDWAGMRECN-UGDNZRGBSA-N - Sucrose [JAN:NF]”. ChemIDplus. 2014年8月12日時点のオリジナルよりアーカイブ。2014年8月10日閲覧。
- ^ NIOSH Pocket Guide to Chemical Hazards 0574
- ^ “蔗 | 漢字一字 | 漢字ペディア”. www.kanjipedia.jp. 2021年8月2日閲覧。
- ^ Question No. 1835 Singapore Science Centre: ScienceNet|Physical Sciences|General Chemistry (ウェブアーカイブ)
- ^ 飛田美穂, 渡辺順, 高宮登美 ほか、「発作性夜間血色素尿症に合併した急性腎不全」『日本腎臓学会誌』1989年 31巻 8号 p.891-895, doi:10.14842/jpnjnephrol1959.31.891
- ^ a b c d e f 河合忠, 屋形稔, 伊藤喜久, 山田俊幸 編集 『異常値の出るメカニズム(第6版)』 p.129 医学書院 2013年2月1日発行 ISBN 978-4-260-01656-8
参考文献
[編集]- 伊藤汎 監修 『砂糖の文化誌 ―日本人と砂糖』 八坂書房、2008年。ISBN 4896949226
関連項目
[編集]外部リンク
[編集]- 砂糖(農畜産業振興機構)
- 国際化学物質安全性カード スクロース (ICSC:1507) 日本語版(国立医薬品食品衛生研究所による), 英語版


