獲得免疫系

獲得免疫系(かくとくめんえきけい、acquired immune system)または適応免疫系(てきおうめんえきけい、adaptive immune system)とは、免疫系のサブシステムであり、病原体を排除またはその増殖を防止する特殊で全身的な細胞やプロセスで構成されている。獲得免疫系は、脊椎動物に見られる2つの主要な免疫戦略のうちの1つである(もう1つは自然免疫系)。
自然免疫系と同様に、獲得免疫系は液性免疫成分と細胞性免疫成分の両方を含み、侵入してきた病原体を破壊する。獲得免疫系は、大まかな共通の病原体に反応するようにあらかじめプログラムされている自然免疫系とは異なり、身体が遭遇した特定の病原体に極めて特異的に反応する。
獲得免疫は、特定の病原体に最初に反応したあと、免疫学的な記憶を作り、将来その病原体に遭遇した時の反応を強化することに繋がる。抗体は、獲得免疫システムの重要な部分である。獲得免疫は長期間にわたって防御することができ、場合によっては生涯にわたって防御することができる。例えば、麻疹から回復した人は一生麻疹から守られるが、水痘のように一生は守られない場合もある。この獲得免疫のプロセスがワクチン接種の基礎となっている。
獲得免疫反応を担うのは、白血球の一種であるリンパ球である。B細胞とT細胞という2種類のリンパ球が、それぞれ「抗体反応」と「細胞介在性免疫反応」を担当する。抗体反応ではB細胞が活性化され、免疫グロブリンとして知られるタンパク質である抗体を分泌する。抗体は血液中を移動し、異物である抗原に結合して不活性化し、抗原が宿主に結合しないようにする[1]。抗原とは、獲得免疫反応を引き起こすあらゆる物質である。花粉症や喘息などのアレルギーは、獲得免疫系が有害な異物と無害な異物を区別できないために起こる。
獲得免疫では、病原体に特異的な受容体が生物の一生の間に「獲得」される(自然免疫では、病原体に特異的な受容体は既に遺伝子にコードされている)。獲得されたこの反応は身体の免疫システムを将来の課題に備えるものであるため、「適応」と呼ばれている(ただし、アレルギーや自己免疫を引き起こす場合には、実際には不適応となることもある)。
このシステムの適応性が高いのは、2つの要因による。まず、体細胞超変異とは、抗体をコードする遺伝子にランダムな遺伝子変異が加速的に起こるプロセスであり、これにより新規の特異性を持つ抗体が作られる。第二に、V(D)J遺伝子再構成では、1つの変数(V)、1つの多様性(D)、1つの結合(J)領域をランダムに選択して遺伝子組み換えを行い、残りを廃棄することで、それぞれのリンパ球で非常にユニークな抗原-受容体遺伝子セグメントの組み合わせを作り出す。この仕組みにより、少数の遺伝子セグメントで膨大な数の異なる抗原受容体が生成され、それぞれのリンパ球で独自に発現するようになる。このような遺伝子の組み換えは、各細胞のDNAに不可逆的な変化をもたらすため、その細胞の子孫は全て同じ受容体の特異性をコードする遺伝子を受け継ぐことになり、その中には長寿命の特異的免疫の鍵となる記憶B細胞や記憶T細胞も含まれる。
機能
[編集]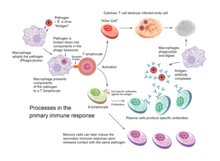
獲得免疫は、脊椎動物において、病原体が自然免疫系を回避し、(1)閾値レベルの抗原を生成し、(2)樹状細胞を活性化する「他人」または「危険」のシグナルを生成した時に起動する[2]。
獲得免疫系の主な機能は以下の通りである。
- 抗原提示の過程で、「自己」の存在下での、「非自己」の特異的抗原の認識
- 特定の病原体や病原体に感染した細胞を最大限に排除するように調整された反応の生成
- 記憶B細胞や記憶T細胞を介して病原体を「記憶」する、免疫学的記憶の発達
ヒトの場合、獲得免疫系が意味のある反応を起こすまでには4 - 7日掛かると言われている[3]。
リンパ球
[編集]Tリンパ球とBリンパ球は、獲得免疫系の細胞である。人体には、白血球の20 - 40%にあたる約2兆個のリンパ球が存在し、その総質量は脳や肝臓とほぼ同じである。末梢血には循環するリンパ球の2%しか含まれておらず、残りの98%は組織やリンパ節、脾臓などのリンパ系内を移動している[1]。ヒトの場合、リンパ球プールの約1~2%が毎時循環しており、細胞が反応する特定の病原体や抗原に遭遇する機会を増やしている[4]。
B細胞とT細胞は、同じ多能性造血幹細胞に由来し、活性化されるまでは互いに同じように見える。B細胞は体液性免疫反応に大きな役割を果たし、T細胞は細胞介在性免疫反応に深く関わっている。無顎類を除く全ての脊椎動物では、B細胞とT細胞は骨髄中の幹細胞によって作られる[5]。T細胞の前駆細胞はその後、骨髄から胸腺に移動し、そこで更に発達する。
成体の末梢リンパ系臓器には、少なくとも3段階に分化したB細胞とT細胞が混在している。
- 未感作B細胞および未感作T細胞(naïve cell):骨髄または胸腺からリンパ系に入ったが、適合する抗原にまだ出会っていない細胞
- 効果細胞(effector cell):一致する抗原によって活性化され、病原体の排除に積極的に関与している細胞
- 記憶細胞(memory cell):過去に感染した際に生き残った細胞
抗原提示
[編集]獲得免疫は、免疫細胞が自分自身の細胞と望ましくない侵入者とを区別する能力に依存している。宿主の細胞は「自己」抗原を発現している。これらの抗原は、細菌の表面やウイルスに感染した宿主細胞の表面に存在する抗原(「非自己」または「外来」抗原)とは異なる。獲得免疫反応は、活性化した樹状細胞の細胞内で外来抗原を認識することによって引き起こされる。
非核細胞(赤血球を含む)を除いて、全ての細胞は主要組織適合性複合体(MHC)分子の働きによって抗原を提示できる[5]。一部の細胞は、抗原を提示したり、未感作T細胞を誘導したりするための特別な機能を備えている。樹状細胞、B細胞、マクロファージは、T細胞の共刺激性受容体が認識する特別な「共刺激性」リガンドを備えており、抗原提示細胞(APC)と呼ばれている。
抗原提示細胞によって活性化されるT細胞には幾つかのサブグループがあり、それぞれのタイプのT細胞は、固有の毒素や微生物の病原体に対処するために特別に装備されている。どのタイプのT細胞が活性化され、どのような反応が起こるかは、APCが最初に抗原に出会った時の状況にもよる[2]。
外因性抗原
[編集]
樹状細胞は、組織内の細菌、寄生虫、毒素などの外来病原体を取り込み、走化性シグナルを介して、T細胞の多いリンパ節に移動する。移動中、樹状細胞は成熟の過程を経て、他の病原体を取り込む能力のほとんどを失い、T細胞とのコミュニケーション能力を身につける。樹状細胞は、酵素を使って病原体を抗原と呼ばれる小さな断片に切り分ける。リンパ節では、樹状細胞はこれらの非自己抗原を主要組織適合性複合体(MHC)と呼ばれる受容体(ヒトではヒト白血球型抗原(HLA)とも呼ばれる)に結合させて、その表面に表示する。このMHC-抗原複合体は、リンパ節を通過するT細胞によって認識される。外来の抗原は通常、MHCクラスII分子に提示され、CD4+ヘルパーT細胞を活性化する[2]。
内因性抗原
[編集]内在性抗原は、細胞内の細菌やウイルスが宿主細胞内で複製されることで産生される。宿主細胞は、酵素を用いてウイルス等のタンパク質を消化し、その断片をMHCに結合させてT細胞に表示する。内因性抗原は通常、MHCクラスI分子に表示され、CD8+細胞傷害性T細胞を活性化する。MHCクラスIは、無核細胞(赤血球を含む)を除いて、すべての宿主細胞に発現している[2]。
Tリンパ球
[編集]CD8+Tリンパ球と細胞傷害性
[編集]細胞障害性T細胞(TC、キラーT細胞、細胞障害性Tリンパ球(CTL)とも呼ばれる)は、ウイルス(およびその他の病原体)に感染した細胞や、その他の損傷や機能不全を起こした細胞の死を誘導するT細胞のサブグループである[2]。
未感作の細胞傷害性T細胞は、T細胞受容体(TCR)がペプチド結合MHCクラスI分子と強く相互作用することで活性化される。この親和性は、抗原-MHC複合体の種類と配向に依存し、CTLと感染細胞を結合させるものである[2]。活性化されたCTLは、クローン選択と呼ばれるプロセスを経て、機能を獲得し、急速に分裂して、「武装した」効果細胞の軍隊を作り出すことになる。活性化されたCTLは、MHCクラスI+ペプチドを持つ細胞を探して全身を駆け巡る[要出典]。
活性化したCTLは、感染した体細胞や機能しない体細胞に触れると、パーフォリンやグラニュライシンという細胞毒素を放出し、標的細胞の細胞膜に孔を開け、イオンや水を感染した細胞に流し込み、細胞を破裂または溶解させる。CTLは、顆粒に包まれたセリンプロテアーゼであるグランザイムを放出し、孔から細胞内に入り込んでアポトーシス(細胞死)を誘導する。感染時の組織損傷を抑えるために、CTLの活性化は厳密に制御されており、一般的には非常に強いMHC-抗原の活性化シグナル、またはヘルパーT細胞による追加の活性化シグナルが必要である(以下参照)[2]。
感染が解消されるとほとんどの効果細胞が死滅し、食細胞がそれを除去するが、これらの細胞の内数個は記憶細胞として残る[5]。後日、同じ抗原に遭遇すると、この記憶細胞は速やかに効果細胞に分化し、効果的な反応を起こすのに必要な時間を劇的に短縮することができる[要出典]。
ヘルパーT細胞
[編集]
CD4+リンパ球は、「補助」T細胞とも呼ばれ、免疫反応のメディエーターであり、獲得免疫反応の能力を確立し、最大化する上で重要な役割を果たしている[2]。ヘルパーT細胞は、細胞毒性や食細胞活性を持たず、感染した細胞を殺したり、病原体を除去したりすることはできないが、本質的には、他の細胞にこれらのタスクを実行させることで、免疫反応を「管理」する。
ヘルパーT細胞は、クラスII MHC分子に結合した抗原を認識するT細胞受容体(TCR)を発現している。未感作のヘルパーT細胞が活性化されると、サイトカインが放出され、活性化したAPC(Antigen-Presenting Cell)を含む多くの種類の細胞の活動に影響を与える。ヘルパーT細胞は、細胞障害性T細胞よりもはるかに穏やかな活性化刺激を必要とする。ヘルパーT細胞は、細胞障害性T細胞の活性化を「助ける」追加のシグナルを提供することができる[5]。
Th1・Th2:ヘルパーT細胞の応答
[編集]古典的には、APCによって2種類の効果CD4+ ヘルパーT細胞応答が誘導され、それぞれが異なるタイプの病原体を排除するように設計されており、Th1とTh2と呼ばれる。感染症がTh1型とTh2型のどちらの反応を惹起するかを決定する要因は完全には解明されていないが、生起された反応は様々な病原体の排除に重要な役割を果たしている[2]。
Th1応答は、インターフェロン-γの産生によって特徴付けられる。このインターフェロン-γは、マクロファージの殺菌活動を活性化し、B細胞にオプソニン化抗体(貪食の目印)と補体結合抗体を作らせ、細胞性免疫を引き起こす[2]。一般的にTh1反応は、細胞内病原体(宿主の細胞内に存在するウイルスや細菌)に対してより効果的である。
Th2応答の特徴は、インターロイキン-5の放出であり、これは寄生虫の排除において好酸球を誘導する[7]。また、Th2は、B細胞のアイソタイプ切り替えを促進するインターロイキン-4を産生する[2]。一般に、Th2反応は細胞外の細菌、蠕虫を含む寄生虫、毒素に対してより効果的である[2]。細胞障害性T細胞と同様に、CD4+ヘルパー細胞の大部分は感染の解決に伴い死滅するが、少数はCD4+記憶細胞として残る。
CD4+効果ヘルパーT細胞のサブセットがより多様化していることは、マウスやヒトを使った科学的研究からも明らかになってきている[8][9]。制御性T細胞(Treg)は、自己抗原に対する異常な免疫反応を制御するために、免疫系を制限・抑制する獲得免疫の重要な負の制御因子として同定されており、自己免疫疾患の発症を制御する重要なメカニズムとなっている[5]。濾胞性ヘルパーT細胞(Tfh)は、効果CD4+T細胞のもう一つの異なる集団で、未感作T細胞の抗原活性化後に発生する。Tfh細胞は、B細胞の体液性免疫に特化しており、二次リンパ系器官の濾胞性B細胞に移動し、高品質な親和性成熟抗体の生成と回収を可能にする積極的な傍分泌シグナルを提供する。Tfh細胞は、Tregsと同様に免疫寛容にも関与しており、Tfh細胞が異常に増加すると、無制限の自己反応性抗体産生が起こり、重篤な全身性自己免疫疾患を引き起こす可能性がある[10]。
CD4+ Tヘルパー細胞の重要性は、HIV感染時に顕著になる。HIVは、CD4+T細胞を特異的に攻撃することで、免疫システムを破壊することができる。CD4+T細胞は、まさにウイルスの排除を促進する細胞であると同時に、生物の一生の間に遭遇する他の全ての病原体に対する免疫を促進する細胞でもある[5]。
γδT細胞
[編集]γδT細胞は、CD4+やCD8+のαβT細胞とは異なるT細胞受容体(TCR)を持ち、ヘルパーT細胞、細胞傷害性T細胞、ナチュラルキラー細胞の特徴を併せ持つ。γδT細胞は、CD1d拘束性のナチュラルキラーT細胞等、不変のTCRを持つ他の「型破り」なT細胞サブセットと同様に、自然免疫と獲得免疫の境界に位置する特徴を持つ。γδT細胞は、V(D)J遺伝子再構成によりTCR遺伝子を再編成して結合多様性を生み出し、記憶表現型を獲得するという点で、獲得免疫の構成要素と考えられる。しかし一方で、様々なサブセットは、制限されたTCRやNK受容体がパターン認識受容体として使用される自然免疫系の一部であると考えることもできる。例えば、このパラダイムによれば、大量のVγ9/Vδ2 T細胞は微生物が産生する一般的な分子に数時間以内に反応し、高度に制限された上皮内Vδ1 T細胞はストレスを受けた上皮細胞に反応するという。
Bリンパ球および抗体産生
[編集]
B細胞は、液性免疫として知られる、血漿やリンパ液中を循環する抗体の生成に関与する主要な細胞である。抗体(免疫グロブリン、Igとも呼ばれる)は、異物を識別して中和するために免疫系が使用する大きなY字型のタンパク質である。哺乳類では、生物学的特性の異なるIgA、IgD、IgE、IgG、IgMの5種類の抗体が存在し、各々が異なる種類の抗原を扱うように進化してきた。活性化されたB細胞は、それぞれが固有の抗原を認識する抗体を産生し、特定の病原体を中和する[2]。
抗原と抗体の結合は、5つの異なる防御機構を惹起する。
- 凝集:処理すべき感染ユニットの数を減らす。
- 補体の活性化:炎症を起こし、細胞を溶かす。
- オプソニン化:抗原を抗体でコーティングすることで、貪食作用を高める。
- 抗体依存性細胞傷害性:標的細胞に付着した抗体が、マクロファージ、好酸球、NK細胞などによって破壊される。
- 中和:細菌やウイルスの粘膜への付着を阻害する。
T細胞と同様に、B細胞も固有のB細胞受容体(BCR)を発現しており、この場合は膜結合型の抗体分子である。B細胞もT細胞と同様に、固有のB細胞受容体(BCR)を発現している。B細胞とT細胞の決定的な違いは、それぞれの細胞がどのように抗原を「見る」かということである。T細胞は抗原を加工した形で、つまりMHC分子の中でペプチドとして認識するのに対し[2]、B細胞は抗原をそのままの形で認識する[2]。B細胞は、同種の(あるいは特異的な)抗原に遭遇すると(そしてヘルパーT細胞(主にTh2型)から追加のシグナルを受け取ると)、更に形質細胞として知られる効果細胞に分化する[2]。
形質細胞は、抗体を分泌する短命な細胞(2~3日)である。この抗体は、抗原に結合して食細胞の標的となり易くし、補体カスケードを引き起こす[2]。約10%の形質細胞が生き残り、長い寿命を持つ抗原特異的記憶B細胞となる[2]。この細胞は、すでに特異的な抗体を産生するようになっており、同じ病原体が宿主に再感染しても、宿主にはほとんど症状が出ないため、迅速に対応することができる。
相同免疫系
[編集]無顎類の場合
[編集]ヤツメウナギやヌタウナギのような無顎類の脊椎動物の原始的な適応免疫系は、B細胞、αβT細胞、自然免疫様γΔT細胞という共通の起源を持つ3つの異なる細胞系譜を持つ[11][12]。古典的な抗体やT細胞受容体の代わりに、これらの動物は可変性リンパ球受容体(略してVLR)と呼ばれる多数の分子を持っている。これらの分子は、有顎脊椎動物の抗原受容体のように、少数(1つか2つ)の遺伝子からしか作られない。これらの分子は、抗体と同様の方法で病原性抗原と結合し、同じ程度の特異性を持つと考えられている[13]。
昆虫の場合
[編集]昆虫を始めとする無脊椎動物は、長い間、自然免疫系しか持っていないと考えられてきた。しかし、近年、獲得免疫の基本的な特徴の幾つかが昆虫で発見されました。その特徴とは、免疫記憶と特異性である。特徴はあるものの、そのメカニズムは脊椎動物のものとは異なる。
昆虫の免疫記憶は、プライミングという現象によって発見された。昆虫は、非致死量の細菌や熱で死んだ細菌にさらされると、その感染の記憶が形成され、以前にさらされた同じ細菌の致死量に耐えることができる[14][15]。昆虫は脊椎動物と異なり、適応免疫に特化した細胞を持たず、血球が適応免疫のメカニズムを担っている。血球は食細胞と同様の機能を持ち、プライミング後はより効果的に病原体を認識して飲み込むことができる[16]。更に、その記憶を子孫に伝えることも可能であることが示された。例えば、ミツバチの場合、女王蜂が細菌に感染すると、生まれたばかりの働き蜂が同じ細菌と戦う能力を高めることができる[17]。また、コクヌストモドキを使った実験でも、病原体に特異的なプライミング記憶が母親と父親の両方から子孫に伝達されることが示されている[18]。
最も一般的に受け入れられている特異性の理論は、Dscam遺伝子に基づくものである。Dscam 遺伝子は、ダウン症細胞接着分子としても知られており、3つの可変Igドメインを含む遺伝子である。これらのドメインは交互にスプライシングされ、多くのバリエーションが存在する[19]。異なる病原体に曝されると、異なるスプライスフォームのdscamが生成されることが示された。異なるスプライスフォームを持つ動物が同じ病原体に曝されたあと、その病原体に特異的なスプライス・フォームを持つ個体だけが生き残る[19]。
昆虫の免疫の特異性を支えるもう一つのメカニズムとして、RNA干渉(RNAi)がある。RNAiは、高い特異性を持つ抗ウイルス免疫の一種である[20]。RNAiには幾つかの異なる経路があり、最終的にはウイルスの複製ができなくなる。そのうちの1つがsiRNAで、長い二本鎖RNAが切断され、タンパク質複合体Ago2-RISCのテンプレートとなり、ウイルスの相補的なRNAを見つけて分解する。細胞質内のmiRNA経路は、Ago1-RISC複合体に結合し、ウイルスのRNA分解のテンプレートとして機能する。最後のpiRNAは、小さなRNAがPiwiタンパク質ファミリーに結合し、トランスポゾン等の移動要素を制御する[21]。このような研究が行われているにも拘わらず、昆虫の免疫プライミングと特異性の正確なメカニズムはよくわかっていない。
免疫記憶
[編集]B細胞やT細胞が活性化されると、一部は記憶B細胞、一部は記憶T細胞となる。これらの記憶細胞は、動物の一生を通じて、有効なBおよびTリンパ球のデータベースを形成する。過去に遭遇した抗原との相互作用により、適切な記憶細胞が選択され活性化される。このようにして、2回目以降の抗原への曝露では、より強力で迅速な免疫反応が得られる。これは、身体の免疫システムが将来の課題に備えるという意味では「適応的」であるが、受容体が自己免疫である場合には、もちろん「不適応的」である。免疫学的記憶には、受動的短期記憶と能動的長期記憶がある。
受動的記憶
[編集]受動記憶は通常、数日から数ヶ月の短期的なものである。生まれたばかりの新生児は、それまでに微生物に触れたことがなく、特に感染に対して脆弱である。母親は何層にも渡って受動的保護を提供している。胎内では、母親のIgGが胎盤を介して直接輸送されるため、出生時には、母親と同じ範囲の抗原特異性を持つ高レベルの抗体を持っている[2]。母乳には抗体(主にIgA)が含まれており、新生児が自分で抗体を合成できるようになるまでの間、乳児の腸に移行して細菌感染から保護する[2]。
胎児は実際には記憶細胞や抗体を作らず、借りているだけなので、これは受動免疫である。胎児は実際には記憶細胞や抗体を作らず、借りているだけだからである。短期的な受動免疫は、抗体を多く含む血清を介して人為的に人から人へと移すこともできる。
能動的記憶
[編集]一般的に、能動的な免疫は長期的なもので、感染後にB細胞やT細胞を活性化させることで獲得でき、また免疫化と呼ばれるプロセスで、ワクチンによって人工的に獲得することもできる。
免疫化
[編集]歴史的に見て、感染症は人類の主要な死因となってきた。この1世紀の間に、その蔓延に対抗するために、公衆衛生と免疫化という2つの重要な要素が開発された[5]。免疫化(一般的にはワクチン接種)とは意図的に免疫反応を誘発することであり、科学者が開発した最も効果的な免疫系の操作方法である[5]。免疫化が成功しているのは、免疫システムが本来持っている特異性と誘導性を利用しているからである。
免疫の原理は、病気の原因となる生物に由来する抗原を導入することで、免疫系を刺激してその生物に対する防御免疫を発達させるが、その抗原自体がその生物の病原性を引き起こすわけではないというものである。抗原(抗体発生源物質;antibody generator の略)とは、特定の抗体と結合して獲得免疫反応を引き起こす物質と定義される[1]。
ウイルスワクチンの多くは弱毒化した生ウイルスを用いているのに対し、細菌ワクチンの多くは無害な毒素成分を含む微生物の無細胞性成分を用いている[1]。多くの無細胞ワクチン由来の抗原は獲得免疫反応を強く惹起しないため、多くの細菌ワクチンでは免疫原性を高めるために自然免疫系の抗原提示細胞を活性化するアジュバントを添加する必要がある[5]。
免疫学的多様性
[編集]
ほぼ全てのタンパク質と多くの多糖類を含むほとんどの大きな分子は、抗原として機能する[2]。抗原の内、抗体分子やリンパ球の受容体と相互作用する部分は、抗原決定基と呼ばれる。ほとんどの抗原には数多くの抗原決定基が含まれており、抗体の産生、特異的なT細胞反応、あるいはその両方を刺激することができる[2]。全リンパ球のうち、特定の抗原に結合できる割合は非常に少なく(0.01%以下)、これは、各抗原に反応する細胞は少数であることを示唆している[5]。
獲得した反応が多数の病原体を「記憶」して排除するためには、免疫系は多くの異なる抗原を区別できなければならず[1]、抗原を認識する受容体は膨大な種類の構成で生産されなければならない。要するに、遭遇する可能性のある異なる病原体毎に(少なくとも)1つの受容体が必要なのである。抗原の刺激がなくても、人間は1兆個以上の異なる抗体分子を作り出す能力を持つ[5]。これらの受容体を作り出す遺伝情報を格納するためには、何百万もの遺伝子が必要であるが、ヒトの全ゲノムに含まれる遺伝子は25,000に満たない[22]。
このような無数の受容体は、クローン選択と呼ばれるプロセスを経て生み出される[1][2]。クローン選択理論によると、動物は生まれたときに、小さな遺伝子群にコードされた情報から、膨大な種類のリンパ球(それぞれが固有の抗原受容体を持つ)をランダムに生成するという。それぞれの抗原受容体を生成するために、これらの遺伝子は、V(D)J遺伝子再構成(組合せ多様性)と呼ばれるプロセスを経ている。この組み換えプロセスにより、体が抗原に出会う前に、膨大な数の受容体と抗体が生成され、免疫系はほぼ無限の抗原に対応することができる[2]。動物の一生を通じて、リンパ球は実際に遭遇した抗原に反応できるものが選択され、その抗原を発現しているあらゆる対象に向けて攻撃する。
自然免疫系と獲得免疫系は、お互いに協力し合って働いている。獲得免疫系の武器であるB細胞やT細胞は、自然免疫系の入力なしには機能しない。T細胞は抗原提示細胞が活性化してくれないと役に立たず、B細胞はT細胞の助けがないと機能しない。一方、自然免疫系は、獲得免疫反応の特殊な作用がなければ、病原体に蹂躙されてしまう可能性が高い。
妊娠中の獲得免疫
[編集]免疫系の要は、「自己」と「非自己」の認識である。従って、「非自己」と見做されるヒトの胎児を、免疫系の攻撃から守るメカニズムは、特に興味深い。拒絶反応が起こらないという不思議な現象を包括的に説明することはできないが、2つの古典的な理由が胎児が許容される理由と考えられる。1つ目は、胎児は子宮という非免疫学的バリアーに守られた体の一部を占めており、免疫系が日常的にパトロールすることはないということである[2]。2つ目は、胎児自身が母体の局所的な免疫抑制を促進する可能性があることである[2]。このような寛容性の誘導についてのより現代的な説明は、妊娠中に子宮内で発現した特定の糖タンパク質が子宮の免疫反応を抑制するというものである(eu-FEDSを参照)。
胎生期の哺乳類(単孔目を除く全ての哺乳類)の妊娠中には、内在性レトロウイルス(ERV)が活性化され、胚の着床時に大量に産生される。ERVには免疫抑制作用があることが知られており、胚を母親の免疫系から守る役割を果たしていることが示唆されている。また、ウイルス融合タンパク質は、胎盤合胞体[23]の形成を引き起こし、発育中の胚と母親の体との間の遊走細胞の交換を制限する(ある種の血球は隣接する上皮細胞の間に挿入することに特化しているため、上皮細胞では充分にできないことである)。免疫抑制作用は、HIVと同様、ウイルスの初期の正常な行動であった。融合タンパク質は、感染した細胞と他の細胞を単純に融合させることで、他の細胞に感染を広げる方法であった(HIVもこれにあたる)。現代の胎生哺乳類の祖先は、このウイルスに感染したあとに進化し、胎児が母親の免疫システムから生き残ることができるようになったと考えられている[24]。
ヒトゲノム計画では、24のファミリーに分類された数千のERVが見つかっている[25]。
免疫ネットワーク理論
[編集]獲得免疫系の働きを説明する理論的枠組みは、免疫ネットワーク理論によって提供されている。この理論は、個別抗原決定基(idiotope)(1つのクローン形質のユニークな分子的特徴、すなわち抗体の可変部分のユニークな抗原決定基(epitope)のセット)と「抗個別抗原」(個別抗原を外来抗原であるかのように反応させる抗原受容体)との間の相互作用に基づいている。この理論は、既存のクローン選択仮説を基に、1974年以降、ニールス・イェルネとジェフリー・W・ホフマンが中心となって展開してきたもので、HIVの病態解明やHIVワクチンの探索に関連するものと考えられている。
獲得免疫の刺激
[編集]ここ数十年の生物医学における最も興味深い進展の一つは、自然免疫を媒介するメカニズムの解明である。自然免疫機構の1つは、補体の活性化などの体液性免疫機構である。もう一つの自然免疫機構は、Toll様受容体のようなパターン認識受容体からなり、インターフェロンやその他のサイトカインの産生を誘導し、単球等の細胞の感染症に対する抵抗力を高める[26]。自然免疫反応で産生されるサイトカインは、獲得免疫反応の活性化因子の一つである[26]。抗体は自然免疫のメカニズムと相加的、相乗的に作用する。不安定なHbS[注 1]は、赤血球の主要なタンパク質であるBand-3をクラスター化している[27]。抗体はこのクラスターを認識し、食細胞による除去を促進する。抗体が付着したクラスター化したBand-3タンパク質は補体を活性化し、補体C3フラグメントは食細胞のCR1補体受容体が認識するオプソニンとなる[28]。
ある集団研究では、鎌状赤血球形質のマラリアに対する防御効果は、マラリア原虫に対する自然免疫反応だけでなく、獲得免疫反応の増強を伴うことが示されており、自然免疫から獲得免疫への移行を示している[29]。
マラリアに繰り返し感染すると、獲得免疫が強化され、異なる表面抗原を発現する寄生虫に対する効果が拡大する。就学前には、ほとんどの子供がマラリアに対する有効な獲得免疫を獲得している。これらの観察結果は、アフリカのほとんどの子供たちが生存している一方で、一部の子供たちが致命的な感染症を発症しているメカニズムについて疑問を投げかけている。
マラリアでは、他の感染症と同様に[26]、自然免疫反応が獲得免疫反応を引き起こし、刺激している。自然免疫と獲得免疫の遺伝子制御は、現在、大規模で盛んな学問分野となっている。
体液性および細胞媒介性の免疫反応は、マラリア原虫の増殖を抑制し、多くのサイトカインがマラリアの病因や感染症の解決に貢献している[30]。
進化
[編集]哺乳類で最もよく研究されている獲得免疫系は、約5億年前に有顎類で生まれた。この防御システムの分子、細胞、組織、および関連するメカニズムのほとんどは、軟骨魚類に見られる[31]。リンパ球の受容体であるIgとTCRは、有顎脊椎動物に見られる。最も古いIgクラスであるIgMは膜に結合しており、軟骨魚類のB細胞を刺激すると分泌される。もう一つのアイソタイプであるサメのIgWは、哺乳類のIgDに関連している。TCRは、α/βとγ/δの両方が、顎口虫類から哺乳類まで全ての動物に存在する。遺伝子の再編成を行う遺伝子セグメントの構成は、軟骨魚類ではクラスター型であるのに対し、骨魚類から哺乳類ではトランスロコン型と異なっている。TCRやIgと同様に、MHCも有顎脊椎動物にしか存在しない。抗原の処理と提示に関与する遺伝子、クラスIとクラスIIの遺伝子は、研究対象となったほぼ全ての種のMHC内で密接に結びついている。
脊椎動物以前の後口動物(ウニ等)の中には、リンパ系細胞が確認できるものがある[32]。これらの細胞は、自然免疫系のパターン認識受容体(PRR)と抗原を結合する。無顎類では、2つのサブセットのリンパ球が可変性リンパ球受容体(VLR)を用いて抗原結合を行う[33]。多様性は、シトシン脱アミノ酵素を介したLRRベースのDNAセグメントの再配置によって生成される[34]。有顎脊椎動物では、IgやTCRの遺伝子セグメントを再編成する組換え活性化遺伝子(RAG)の存在は確認されていない。
Ig、TCR、MHC分子を基盤とする獲得免疫の進化は、RAGトランスポゾン(ウイルス由来の可能性あり)の移入と、2回の全ゲノム重複という2つの大きな進化から生じたと考えられている[31]。獲得免疫の分子はよく保存されているが、同時に急速に進化している。しかし、比較検討の結果、多くの特徴が分類群間で極めて均一であることが判明した。獲得免疫の主要な特徴は全て、早い時期に生まれたものである。無顎類は、遺伝子の再配列に依存して、Ig分子とTCR分子に類似した機能的二分法を持つ多様な免疫受容体を生成する、異なる獲得免疫を持っている[35]。獲得免疫の活性化に重要な役割を果たしている自然免疫系は、無脊椎動物や植物の最も重要な防御システムである。
獲得免疫の種類
[編集]免疫は、能動的に獲得する場合と受動的に獲得する場合がある。積極的に免疫を獲得するのは、人が異物に曝され、免疫系が反応する場合である。受動的な免疫とは、抗体がある宿主から別の宿主に移される場合を指す。能動的に獲得した免疫も受動的に獲得した免疫も、自然または人工的な手段で得ることができる。
- 自然獲得能動免疫 ― 自然に抗原に曝され、病気になり、その後回復する場合。
- 自然獲得受動免疫 ― 母親からその乳児への自然な抗体の移動を伴う。抗体は母親の胎盤を通過して胎児に移行する。また、抗体は初乳の分泌物として母乳を介して移行することもある。
- 人工獲得能動免疫 ― ワクチン接種(死んだ抗原や弱体化した抗原を宿主の細胞に導入する)によって行われる。
- 人工獲得受動免疫 ― 抗原ではなく抗体を人体に導入する。これらの抗体は、その病気に対して既に免疫を持っている動物やヒトのものである。
| 自然獲得 | 人工獲得 | |
|---|---|---|
| 能動 | 抗原が自然に体内に入る | ワクチンで抗原を導入する |
| 受動 | 抗体は母親から、胎盤を介して胎児に、または母乳を介して乳児に受け継がれる | 予め免疫化された血清から得られた抗体を注射で導入する |
脚注
[編集]注釈
[編集]- ^ ヘモグロビンS。異常ヘモグロビンの一種で、鎌状赤血球貧血や溶血性貧血等の原因となる。
出典
[編集]- ^ a b c d e f Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). Molecular Biology of the Cell (4th ed.). New York and London: Garland Science. ISBN 0-8153-3218-1
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z Janeway CA, Travers P, Walport M, Shlomchik MJ (2001). Immunobiology (5th ed.). New York and London: Garland Science. ISBN 0-8153-4101-6
- ^ The innate and adaptive immune systems. Institute for Quality and Efficiency in Health Care (IQWiG). (4 August 2016)
- ^ “Microbiology and Immunology On-Line Textbook”. University of South Carolina School of Medicine. 2 September 2008時点のオリジナルよりアーカイブ。2021年11月17日閲覧。
- ^ a b c d e f g h i j k Janeway CA, Travers P, Walport M, Shlomchik MJ (2005). Immunobiology. (6th ed.). Garland Science. ISBN 0-443-07310-4
- ^ a b c “Understanding the Immune System How It Works”. NIH Publication No. 03-5423. National Institute of Allergy and Infectious Diseases National Cancer Institute, U.S. Department of Health and Human Services National Institutes of Health (September 2003). 2007年1月3日時点のオリジナルよりアーカイブ。2021年11月18日閲覧。
- ^ Spencer LA, Weller PF (2010). “Eosinophils and Th2 immunity: contemporary insights”. Immunology and Cell Biology 88 (3): 250-256. doi:10.1038/icb.2009.115. PMC 3589820. PMID 20065995.
- ^ Szabo PA, Levitin HM, Miron M, Snyder ME, Senda T, Yuan J, Cheng YL, Bush EC, Dogra P, Thapa P, Farber DL, Sims PA (October 2019). “Single-cell transcriptomics of human T cells reveals tissue and activation signatures in health and disease”. Nature Communications 10 (1): 4706. Bibcode: 2019NatCo..10.4706S. doi:10.1038/s41467-019-12464-3. PMC 6797728. PMID 31624246.
- ^ Magen A, Nie J, Ciucci T, Tamoutounour S, Zhao Y, Mehta M, Tran B, McGavern DB, Hannenhalli S, Bosselut R (December 2019). “+ T Cells” (英語). Cell Reports 29 (10): 3019-3032.e6. doi:10.1016/j.celrep.2019.10.131. PMC 6934378. PMID 31801070.
- ^ Weinstein JS, Hernandez SG, Craft J (May 2012). “T cells that promote B-Cell maturation in systemic autoimmunity”. Immunological Reviews 247 (1): 160-171. doi:10.1111/j.1600-065x.2012.01122.x. PMC 3334351. PMID 22500839.
- ^ Flajnik, Martin F. (19 March 2018). “A cold-blooded view of adaptive immunity”. Nature Reviews Immunology 18 (7): 438-453. doi:10.1038/s41577-018-0003-9. PMC 6084782. PMID 29556016.
- ^ Kasamatsu, Jun (January 2013). “Evolution of innate and adaptive immune systems in jawless vertebrates” (英語). Microbiology and Immunology 57 (1): 1-12. doi:10.1111/j.1348-0421.2012.00500.x. ISSN 0385-5600. PMID 22924515.
- ^ Alder MN, Rogozin IB, Iyer LM, Glazko GV, Cooper MD, Pancer Z (December 2005). “Diversity and function of adaptive immune receptors in a jawless vertebrate”. Science 310 (5756): 1970-1973. Bibcode: 2005Sci...310.1970A. doi:10.1126/science.1119420. PMID 16373579.
- ^ Mikonranta L, Mappes J, Kaukoniitty M, Freitak D (March 2014). “Insect immunity: oral exposure to a bacterial pathogen elicits free radical response and protects from a recurring infection”. Frontiers in Zoology 11 (1): 23. doi:10.1186/1742-9994-11-23. PMC 3975449. PMID 24602309.
- ^ Sadd BM, Schmid-Hempel P (June 2006). “Insect immunity shows specificity in protection upon secondary pathogen exposure” (英語). Current Biology 16 (12): 1206-1210. doi:10.1016/j.cub.2006.04.047. PMID 16782011.
- ^ Pham LN, Dionne MS, Shirasu-Hiza M, Schneider DS (March 2007). “A specific primed immune response in Drosophila is dependent on phagocytes”. PLOS Pathogens 3 (3): e26. doi:10.1371/journal.ppat.0030026. PMC 1817657. PMID 17352533.
- ^ Hernández López J, Schuehly W, Crailsheim K, Riessberger-Gallé U (June 2014). “Trans-generational immune priming in honeybees”. Proceedings. Biological Sciences 281 (1785): 20140454. doi:10.1098/rspb.2014.0454. PMC 4024302. PMID 24789904.}
- ^ Roth O, Joop G, Eggert H, Hilbert J, Daniel J, Schmid-Hempel P, Kurtz J (March 2010). “Paternally derived immune priming for offspring in the red flour beetle, Tribolium castaneum”. The Journal of Animal Ecology 79 (2): 403-413. doi:10.1111/j.1365-2656.2009.01617.x. PMID 19840170.
- ^ a b Dong Y, Taylor HE, Dimopoulos G (July 2006). “AgDscam, a hypervariable immunoglobulin domain-containing receptor of the Anopheles gambiae innate immune system”. PLOS Biology 4 (7): e229. doi:10.1371/journal.pbio.0040229. PMC 1479700. PMID 16774454.
- ^ Meki IK, Kariithi HM, Parker AG, Vreysen MJ, Ros VI, Vlak JM, van Oers MM, Abd-Alla AM (November 2018). “RNA interference-based antiviral immune response against the salivary gland hypertrophy virus in Glossina pallidipes”. BMC Microbiology 18 (Suppl 1): 170. doi:10.1186/s12866-018-1298-1. PMC 6251114. PMID 30470195.
- ^ Rubio M, Maestro JL, Piulachs MD, Belles X (June 2018). “Conserved association of Argonaute 1 and 2 proteins with miRNA and siRNA pathways throughout insect evolution, from cockroaches to flies”. Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms 1861 (6): 554?60. doi:10.1016/j.bbagrm.2018.04.001. hdl:10261/168051. PMID 29656113.
- ^ International Human Genome Sequencing Consortium (October 2004). “Finishing the euchromatic sequence of the human genome”. Nature 431 (7011): 931-945. Bibcode: 2004Natur.431..931H. doi:10.1038/nature03001. PMID 15496913.
- ^ Mi S, Lee X, Li X, Veldman GM, Finnerty H, Racie L, LaVallie E, Tang XY, Edouard P, Howes S, Keith JC, McCoy JM (February 2000). “Syncytin is a captive retroviral envelope protein involved in human placental morphogenesis”. Nature 403 (6771): 785-789. Bibcode: 2000Natur.403..785M. doi:10.1038/35001608. PMID 10693809.
- ^ Villarreal, Luis P.. “The Viruses That Make Us: A Role For Endogenous Retrovirus In The Evolution Of Placental Species”. University of California, Irvine (lecture notes). 2007年7月15日時点のオリジナルよりアーカイブ。2008年2月3日閲覧。
- ^ Villarreal, Luis P. (Oct 2001). “Persisting Viruses Could Play Role in Driving Host Evolution”. ASM News. オリジナルの2009-05-08時点におけるアーカイブ。.
- ^ a b c Uematsu S, Akira S (May 2007). “Toll-like receptors and Type I interferons”. The Journal of Biological Chemistry 282 (21): 15319-15323. doi:10.1074/jbc.R700009200. PMID 17395581.
- ^ Kuross SA, Rank BH, Hebbel RP (April 1988). “Excess heme in sickle erythrocyte inside-out membranes: possible role in thiol oxidation”. Blood 71 (4): 876-882. doi:10.1182/blood.V71.4.876.876. PMID 3355895.
- ^ Arese P, Turrini F, Schwarzer E (2005). “Band 3/complement-mediated recognition and removal of normally senescent and pathological human erythrocytes”. Cellular Physiology and Biochemistry 16 (4?6): 133-146. doi:10.1159/000089839. PMID 16301814.
- ^ Williams TN, Mwangi TW, Roberts DJ, Alexander ND, Weatherall DJ, Wambua S, Kortok M, Snow RW, Marsh K (May 2005). “An immune basis for malaria protection by the sickle cell trait”. PLOS Medicine 2 (5): e128. doi:10.1371/journal.pmed.0020128. PMC 1140945. PMID 15916466.
- ^ Schofield L, Grau GE (September 2005). “Immunological processes in malaria pathogenesis”. Nature Reviews. Immunology 5 (9): 722-735. doi:10.1038/nri1686. PMID 16138104.
- ^ a b Flajnik MF, Kasahara M (January 2010). “Origin and evolution of the adaptive immune system: genetic events and selective pressures”. Nature Reviews. Genetics 11 (1): 47-59. doi:10.1038/nrg2703. PMC 3805090. PMID 19997068.
- ^ Hibino T, Loza-Coll M, Messier C, Majeske AJ, Cohen AH, Terwilliger DP, Buckley KM, Brockton V, Nair SV, Berney K, Fugmann SD, Anderson MK, Pancer Z, Cameron RA, Smith LC, Rast JP (December 2006). “The immune gene repertoire encoded in the purple sea urchin genome”. Developmental Biology 300 (1): 349?65. doi:10.1016/j.ydbio.2006.08.065. PMID 17027739.
- ^ Pancer Z, Amemiya CT, Ehrhardt GR, Ceitlin J, Gartland GL, Cooper MD (July 2004). “Somatic diversification of variable lymphocyte receptors in the agnathan sea lamprey”. Nature 430 (6996): 174-180. Bibcode: 2004Natur.430..174P. doi:10.1038/nature02740. hdl:2027.42/62870. PMID 15241406.
- ^ Rogozin IB, Iyer LM, Liang L, Glazko GV, Liston VG, Pavlov YI, Aravind L, Pancer Z (June 2007). “Evolution and diversification of lamprey antigen receptors: evidence for involvement of an AID-APOBEC family cytosine deaminase”. Nature Immunology 8 (6): 647-656. doi:10.1038/ni1463. PMID 17468760.
- ^ Boehm T (May 2011). “Design principles of adaptive immune systems”. Nature Reviews. Immunology 11 (5): 307-317. doi:10.1038/nri2944. PMID 21475308.
