キラル中心
キラル中心(キラルちゅうしん、英: Stereocenter)とは、分子のキラリティーを生じさせる元となる原子をいう[1]。不斉原子(ふせいげんし)または不斉中心(ふせいちゅうしん)ともいう。
最も多く見られるキラル中心は、異なる 4 つの原子または置換基に共有結合している炭素(不斉炭素原子[2])である。かつて当用漢字時代には不整(ふせい)という字が当てられたことがあり[3]、不整という表記が残っている辞書[4]もある。常用漢字には斉の字が追加されたので、再び不斉が使われることになった。
キラル中心とキラリティー
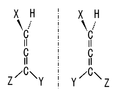
[編集]炭素原子には最大4個の原子が共有結合でき、このとき、4本の結合は全て単結合であり、4個の原子は炭素原子を中心とする正四面体のほぼ頂点に位置する。このとき4個の置換基が全て鏡映対称であれば、この分子の鏡像同士はどう移動させても重ね合わせられない(図1A)。すなわちこの分子はキラルであり、その鏡像同士は互いにエナンチオマーである。
-
図1A.不斉炭素の鏡像(XYZは鏡映対称)
-
図1B.不斉炭素の鏡像(RとSは鏡像対)
-
図2A.アレン誘導体の鏡像(XYZは鏡映対称)
-
図2B.アレン誘導体の鏡像(XYは鏡映対称)
不斉炭素原子は分子がキラルとなるひとつの要因だが、必要条件でも十分条件でもない。例えば図1Bのように、4個の置換基のうち2個は鏡映対称で2個は一対の鏡像であれば、この分子の鏡像同士は重ね合わせることができてキラルではない。不斉原子を複数持つメソ化合物もキラルではない。また、アレン誘導体のように、不斉炭素原子を持たないがキラルな分子もある。
炭素以外のキラル中心
[編集]炭素原子以外でも、4 本の単結合で正四面体のほぼ頂点に位置する原子と結合する原子なら同様なことが成り立つ。例えば、炭素と同じく周期表で第14族元素のケイ素・ゲルマニウム・鉛はキラル中心になりうる。またアンモニウムも同様にキラル中心になりうる。
周期表で第15族元素の窒素やリンは通常 3 本の共有結合しか持たないが、4本目の結合の代わりに孤立電子対を持ち、3個の単結合原子と1個の孤立電子対が正四面体のほぼ頂点に位置するので、キラル中心となりうる。しかしこれらの原子は、3個の単結合原子が同一平面となる遷移状態を経て、傘が裏返るようなピラミッド型分子の立体反転を起こし、エナンチオマー間の交換が起こる。通常のアミンの窒素原子では、このような立体反転の障壁が低く交換速度が速いため不斉原子とはならないが、ホスフィンのリン原子では立体反転の障壁が高くエナンチオマーが単離できる。
錯体には中心金属原子周りの配位子の配置による立体異性体が存在するものがあり、エナンチオマーが存在する錯体では中心金属原子が不斉中心となる。
キラル中心とジアステレオマー
[編集]n個の不斉原子を持つ分子中には、重なりを無視すれば2n個の立体異性体が考えられる。これらの立体異性体の中で互いに鏡像となる対は、互いにエナンチオマーであり、互いに鏡像ではない対は互いにジアステレオマーである。しかしジアステレオマーの定義はエナンチオマー以外の立体異性体であり、複数の不斉原子を持たないジアステレオマーもありうる。
関連項目
[編集]参考文献
[編集]- ^ Chemistry (IUPAC), The International Union of Pure and Applied. “IUPAC - chirality centre (C01060)”. goldbook.iupac.org. 2023年10月15日閲覧。
- ^ http://goldbook.iupac.org/A00479.html IUPAC Gold Book - asymmetric carbon atom]
- ^ 日本化学会(編)「標準-化学用語辞典-第2版」丸善(2005/03,初版1991/03)
- ^ 化学大辞典編集委員会(編)「化学大辞典-第3版」共立(2001/09,初版1960/09)