L型カルシウムチャネル
| Calcium channel, voltage-dependent | |
|---|---|
 L型カルシウムチャネル複合体(α1S、α2、δ、β、γサブユニット)の結晶構造 | |
| 識別子 | |
| 略号 | Calcium channel, voltage-dependent |


L型カルシウムチャネル(エルがたカルシウムチャネル、英: L-type calcium channel)は、電位依存性カルシウムチャネルの高電位活性化型ファミリーの1つである[2]。ジヒドロピリジン受容体(DHP受容体、dihydropyridine receptor)とも呼ばれる。"L"は、活性化が長時間持続すること(long-lasting)を意味している。このチャネルには、Cav1.1、Cav1.2、Cav1.3、Cav1.4の4種類が存在する。
L型カルシウムチャネルは、骨格筋、平滑筋、心筋における興奮収縮連関、そして副腎皮質の内分泌細胞におけるアルドステロンの分泌を担っている[1]。神経にも存在し、内分泌細胞のL型カルシウムチャネルの補助のもと、神経ホルモンや神経伝達物質を調節している。遺伝子発現、mRNAの安定性、神経生存、虚血による軸索損傷、シナプス効力、他のイオンチャネルの活性化や不活性化にも関与していることが知られている[3]。
心筋細胞では、L型カルシウムチャネルは内向きCa2+電流(ICaL)を担い、2型リアノジン受容体(RyR2)を活性化して筋小胞体からのカルシウム放出の引き金を引く(カルシウム誘発性カルシウム放出)[4]。これらのチャネルのリン酸化はカルシウムの透過性を高め、心筋細胞の収縮性を高める。
L型カルシウムチャネルに対する拮抗薬は、心臓のチャネルに高い親和性を有するか(ベラパミルなどのフェニルアルキルアミン系)、血管のチャネルか(ニフェジピンなどのジヒドロピリジン系)によって、それぞれ抗不整脈薬もしくは降圧薬として利用される[5]。
歴史
[編集]1953年、Paul Fattとバーナード・カッツは甲殻類の筋肉に電位依存性カルシウムチャネルを発見した。発見されたチャネルには異なる活性化電位とカルシウム透過性を示すものがあったため、高電位活性化型(HVA)チャネルと低電位活性化型(LVA)チャネルへの分類が行われた。その後の実験により、HVAチャネルは1,4-ジヒドロピリジン(DHP)誘導体によって遮断されることが発見された[6]。DHPを用いることで、HVAチャネルにはさらに組織特異性や反応性の異なるものがあることが発見され、L型、P型、N型への分類がなされた[3]。L型カルシウムチャネルのペプチド配列が決定され、α1S(骨格筋)、α1C(心筋)、α1D(脳)、α1F(網膜)という4種類のα1サブユニットが存在することが発見された。その後も電位依存性カルシウムチャネルのα1サブユニットに対して多くの研究が行われ、2000年には新たな命名法によってL型カルシウムチャネルはCav1、そして各タイプはCav1.1、Cav1.2、Cav1.3、Cav1.4と呼ばれるようになった[3]。Cav1サブユニットに関する研究によって、その構造、機能、医薬品への応用など、多くのことが明らかにされ続けている[7]。
構造
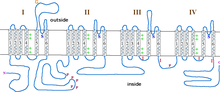
[編集]L型カルシウムチャネルは、α1(170–240 kDa)、α2(150 kDa)、δ(17–25 kDa)、β(50–78 kDa)、γ(32 kDa)の5つのサブユニットから構成される[8]。α2、δ、βサブユニットは、α1サブユニットに非共有結合的に結合しており、α1サブユニットのイオン輸送や生物物理学的特性を調節している。α2、δサブユニットは細胞外に位置し、β、γサブユニットは細胞質基質側に位置する[8]。
α1サブユニットには、電位検知ドメイン、透過性ポア、ゲート装置が含まれている[9]。α1サブユニットは4つの相同なドメイン(ドメインI–IV)から構成され、各ドメインには6つの膜貫通αヘリックス(S1–S6)が含まれている。S4は電位センサーとして機能し、イオンの透過性と選択性はS5とS6の間に位置するポアループによって決定される[10]。C末端領域には、EFハンドやIQモチーフといったチャネル機能の調節やタンパク質間相互作用に重要な部位が含まれている[11]。
βサブユニットには4つのアイソフォーム(β1–β4)が存在し、チャネル機能を調節することが知られている。βサブユニットのα1結合ポケットは、α1サブユニットのドメインIとIIの間の細胞質基質リンカー領域に結合する[7][12]。各アイソフォームにはSH3ドメインとグアニル酸キナーゼ様ドメイン(GKドメイン)が含まれており、両者はHOOKドメインと呼ばれる、構造をとらない領域によって隔てられている[12]。
α2サブユニットとδサブユニットはジスルフィド結合によって連結され(そのためα2δサブユニットと呼ばれることもある)、α1サブユニットと相互作用する[7]。α2δ-1からα2δ-4まで4つのアイソフォームが知られており、α2サブユニットにはVWAドメインとCacheドメインが含まれている。α2サブユニットは細胞外に位置するのに対し、δサブユニットは細胞膜中に位置し、その一部はGPIアンカーによって固定されている[12]。
γサブユニットには8つのアイソフォーム(γ1–γ8)が存在し、α1サブユニットに連結されているが、筋細胞中のCav1.1、Cav1.2チャネルにのみ存在する[12]。γサブユニットの役割はあまり明らかになっていない。
調節
[編集]L型カルシウムチャネルについて最もよく知られている特性の1つが、1,4-ジヒドロピリジン(DHP)に対する特有の感受性である[3]。他の電位依存性カルシウムチャネルとは異なり、L型カルシウムチャネルはω-コノトキシンGVIAやω-アガトキシンIVAといった阻害剤に対しては耐性を示す[3]。
L型カルシウムチャネルのポアの開口はα1サブユニット内で生じる。膜の脱分極によってS4が移動し、ゲートが開放される[13]。
L型カルシウムチャネルの自己阻害の最たる方法は、Ca2+/カルモジュリン複合体によるものである[14]。ポアが開口してカルシウムの流入が引き起こされると、カルシウムはチャネルに前もって結合していたカルモジュリンに結合し、EFハンドモチーフのコンフォメーション変化を引き起こす。このコンフォメーション変化によってポアとの相互作用が促進され、迅速な阻害が引き起こされる[14]。ポアとEFハンドがどこでどのように相互作用しているのかに関しては議論がある[14]
CTM(C-terminal modulator)と呼ばれるC末端領域には、DCRDと呼ばれる正に帯電したαヘリックスと、IQモチーフ(カルモジュリン相互作用部位)の直後に位置する、PCRDと呼ばれる負に帯電したヘリックスが存在する。この2つのヘリックスはカルモジュリンと競合する構造を形成し、チャネルが開いた状態の可能性を低下させ、またカルシウム依存性阻害を抑制する[7]。
βサブユニットは、パルミトイル化[6]やRNA編集[7]によってチャネルに異なる性質をもたらす。βサブユニットの発現の上昇や低下による調節も行われる。βサブユニットはチャネルが開く可能性や細胞膜中での活性を高め、またチャネルのユビキチン化に対抗する[6]。
L型カルシウムチャネルは、Gタンパク質共役受容体や交感神経系によっても調節されている[6]。Aキナーゼアンカータンパク質と複合体を形成したL型カルシウムチャネルは、Gタンパク質共役受容体を介して活性化されたプロテインキナーゼAによってリン酸化されることでカルシウム電流が増大し、開いた状態の可能性が高まり、不活化状態からの回復が加速する。また、Gタンパク質共役受容体を介して活性化されたホスホリパーゼCはポリホスホイノシチドの分解を引き起こし、カルシウム電流を20–30%低下させる[7]。交感神経系は、βアドレナリン受容体が刺激された際にC末端断片の切断をもたらし、チャネルの活性化を高めることで、L型カルシウムチャネルを調節することが示されている[6]。
遺伝子
[編集]出典
[編集]- ^ a b “Voltage-gated calcium channels in the human adrenal and primary aldosteronism”. The Journal of Steroid Biochemistry and Molecular Biology 144 Pt B (part B): 410–416. (October 2014). doi:10.1016/j.jsbmb.2014.08.012. PMID 25151951.
- ^ “T-Type Calcium Channel: A Privileged Gate for Calcium Entry and Control of Adrenal Steroidogenesis”. Frontiers in Endocrinology 7: 43. (2016). doi:10.3389/fendo.2016.00043. PMC 4873500. PMID 27242667.
- ^ a b c d e “L-type calcium channels: the low down”. Journal of Neurophysiology 92 (5): 2633–2641. (November 2004). doi:10.1152/jn.00486.2004. PMID 15486420.
- ^ “Calcium channels--basic aspects of their structure, function and gene encoding; anesthetic action on the channels--a review”. Canadian Journal of Anaesthesia 49 (2): 151–164. (February 2002). doi:10.1007/BF03020488. PMID 11823393.
- ^ Hughes, Alun (2017). “Calcium channel blockers”. In Bakris, George. Hypertension: a companion to Braunwald's heart disease (Third ed.). Philadelphia, PA: Elsevier Health Sciences. pp. 242–253. ISBN 9780323508766. OCLC 967938982
- ^ a b c d e “Voltage-gated calcium channels: their discovery, function and importance as drug targets”. Brain and Neuroscience Advances 2: 2398212818794805. (October 2018). doi:10.1177/2398212818794805. PMC 6179141. PMID 30320224.
- ^ a b c d e f “L-type Ca2+ channels in heart and brain”. Wiley Interdisciplinary Reviews. Membrane Transport and Signaling 3 (2): 15–38. (March 2014). doi:10.1002/wmts.102. PMC 3968275. PMID 24683526.
- ^ a b “The L-type calcium channel in the heart: the beat goes on”. The Journal of Clinical Investigation 115 (12): 3306–3317. (December 2005). doi:10.1172/JCI27167. PMC 1297268. PMID 16322774.
- ^ “Voltage-gated calcium channels | Introduction | BPS/IUPHAR Guide to PHARMACOLOGY”. www.guidetopharmacology.org. 2019年11月28日閲覧。
- ^ “International Union of Pharmacology. XLVIII. Nomenclature and structure-function relationships of voltage-gated calcium channels”. Pharmacological Reviews 57 (4): 411–425. (December 2005). doi:10.1124/pr.57.4.5. PMID 16382099.
- ^ Ames, James B. (2021-12-02). “L-Type Ca2+ Channel Regulation by Calmodulin and CaBP1”. Biomolecules 11 (12): 1811. doi:10.3390/biom11121811. ISSN 2218-273X. PMC 8699282. PMID 34944455.
- ^ a b c d “L-type calcium channel targeting and local signalling in cardiac myocytes”. Cardiovascular Research 98 (2): 177–186. (May 2013). doi:10.1093/cvr/cvt021. PMC 3633156. PMID 23417040.
- ^ Hering, S.; Zangerl-Plessl, E.-M.; Beyl, S.; Hohaus, A.; Andranovits, S.; Timin, E. N. (2018-09). “Calcium channel gating”. Pflugers Archiv: European Journal of Physiology 470 (9): 1291–1309. doi:10.1007/s00424-018-2163-7. ISSN 1432-2013. PMC 6096772. PMID 29951751.
- ^ a b c “Switching off calcium-dependent inactivation in L-type calcium channels by an autoinhibitory domain”. Proceedings of the National Academy of Sciences of the United States of America 103 (42): 15657–15662. (October 2006). Bibcode: 2006PNAS..10315657W. doi:10.1073/pnas.0604621103. PMC 1622877. PMID 17028172.
関連文献
[編集]- “L-type calcium channel modulates mechanosensitivity of the cardiomyocyte cell line H9c2”. Cell Calcium 79: 68–74. (May 2019). doi:10.1016/j.ceca.2019.02.008. PMID 30836292.
関連項目
[編集]外部リンク
[編集]- L-Type Calcium Channel - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
